
- •Производство некоторых типов ск в ссср и России
- •Общая схема аддиционной полимеризации
- •J(m)n m* неактивный полимер (обрыв цепи)
- •Основные отличия ионной полимеризации от радикальной:
- •Общая кинетическая картина анионной полимеризации осложнена множественностью форм существования активных центров. (Разная степень диссоциации, сольватации, образования ассоциатов)
- •Рост цепи
- •Образование промежуточного комплекса:
- •Известные типы каталитических систем:
- •Катализаторы Циглера – Натта
- •Реакционная способность алюминийорганических соединений убывает в ряду:
- •Используются две кристаллические модификации трихлорида титана (TiCl3):
- •R содержит одно и то же число атомов углерода.
- •R содержит различное число атомов углерода.
- •Чем больше длина алкильного заместителя в алюминийорганическом соединении, тем сильнее смещается каталитическая активность в сторону больших соотношений Al:Ti.
- •Катализаторы на основе редкоземельных металлов (лантаноидов)
- •Активность катализатора определяется природой лантаноида
- •При получении катализаторов наиболее часто применяют неодим и разеодим, или их смесь («дидим»).
- •Влияние природа галоида в составе катализатора на микроструктуру полимера, его выход и молекулярную массу (оцениваемую по характеристической вязкости [η])
- •Механизм анионно-координационного катализа
- •Различают син- (транс) и анти- (цис) конфигурации комплекса:
- •Большую роль играет также скорость реакции роста цепи.
- •Рост цепи при образовании 1,4-цис полидиена
- •Рост цепи при образовании 1,4-транс полидиена
- •В качестве модификаторов используют:
- •Механизм действия модификатора может включать:
- •Модификатор может взаимодействовать с
- •Степень окисления переходного металла
- •Получение алюминийорганических соединений
- •Изопреновые каучуки Общие вопросы синтеза полиизопренов
- •Получение ски на литийорганических катализаторах
- •Получение ски на катализаторах Циглера-Натта
- •Типы и свойства изопреновых каучуков Характеристики изопреновых каучуков, производимых в разных странах мира
- •Свойства наиболее массовых изопреновых каучуков, выпускаемых ао «Нижнекамскнефтехим»
- •Каучук ски-5
- •Полимеризация олефинов
- •Синтез и активация металлоценов
- •Механизм металлоценового катализа
- •Получение стереоблочного полипропиленового каучука путем газофазной полимеризации.
- •Свойства и области применения стереоблочного эластомерного полипропилена.
- •Получение скэпт с использованием газофазного процесса.
Известные типы каталитических систем:
- -аллильные комплексы переходных металлов;
- катализаторы Циглера-Натта в том числе металлоценовые катализаторы;
- окисно-металлические катализаторы;
- алфиновые катализаторы.
Каталитические системы по фазовому состоянию могут быть – гомогенными и гетерогенными.
-Аллильные комплексы переходных металлов
Аллильные производные переходных металлов, содержащие связь металл – углерод, чрезвычайно нестабильны. Наличие в металлорганическом соединении атомов галогенов или других стабилизирующих лигандов заметно повышает устойчивость комплексов.
Еще более стабильны металлорганические соединения, имеющие связь между атомом переходного металла и ненасыщенной органической группировкой, которая выступает в качестве доноров -электронов.
В образовании связи переходный металл – ненасыщенный лиганд могут участвовать и большее число электронов лиганда. При этом, электронное облако распределяется между несколькими атомами углерода – делокализуется.
Невысокая энергия делокализации объясняет сравнительно легкий переход -аллильной группы в -аллильную.
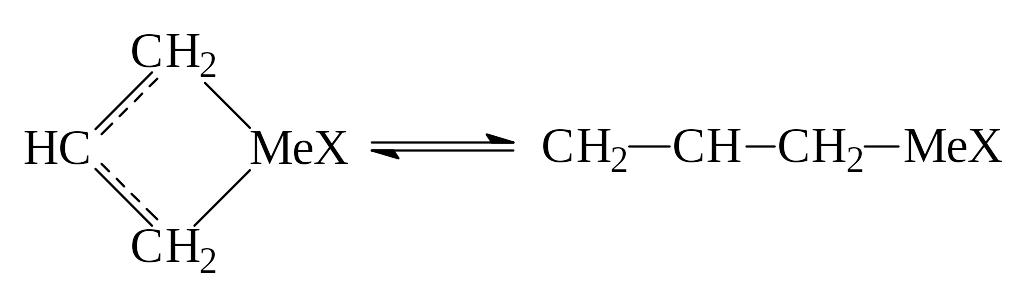
В качестве непредельного соединения может выступать мономер или специальный компонент.
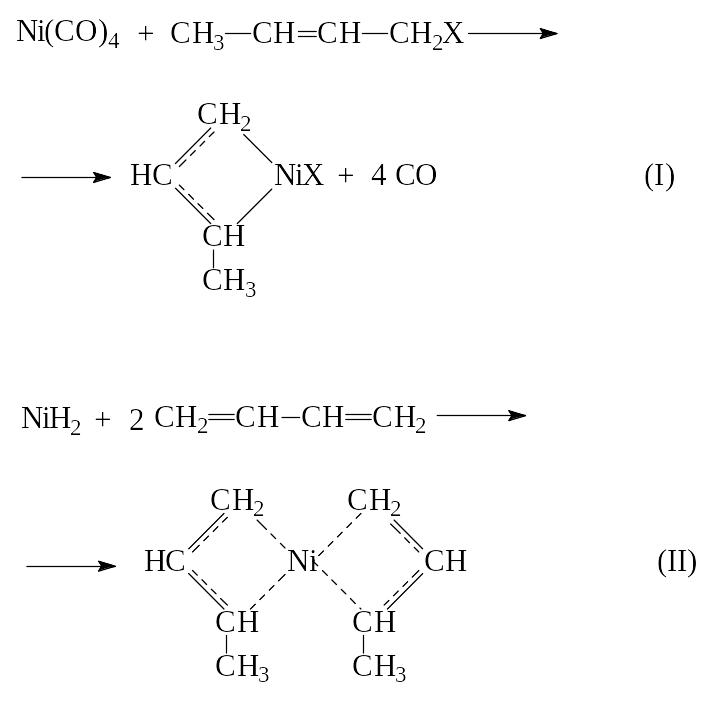
-Аллильные активные центры могут также образовываться в результате взаимодействия бутадиена с дефектными солями переходных металлов.
Так, при прогреве NiCl2 в вакууме при 250-300С происходит потеря 0,1-0,2% хлора с поверхности кристалла.
В результате в этих точках возникают атомы одновалентного никеля (дефект соли), которые реагируют с молекулой бутадиена с переносом электрона:

Радикальные центры быстро исчезают в процессе рекомбинации и диспропорционирования, а образующийся катализатор характеризуется высокой стереоспецифичностью.
Характерной особенностью этих катализаторов является то, что их активность и стереоспецифичность при образовании 1,4-цис-полимероврезко повышаются в присутствии кислот Льюиса – AlCl3, VCl4, TiCl4, ZnCl2, NiCl2, органических акцепторов электронов – производные хинонов, трихлоуксусная кислота.
Так, при взаимодействии кислот Льюиса с галогенидами переходных металлов и диеновым углеводородом образуются -аллильные каталитические комплексы за счет присоединения мономера по связи:
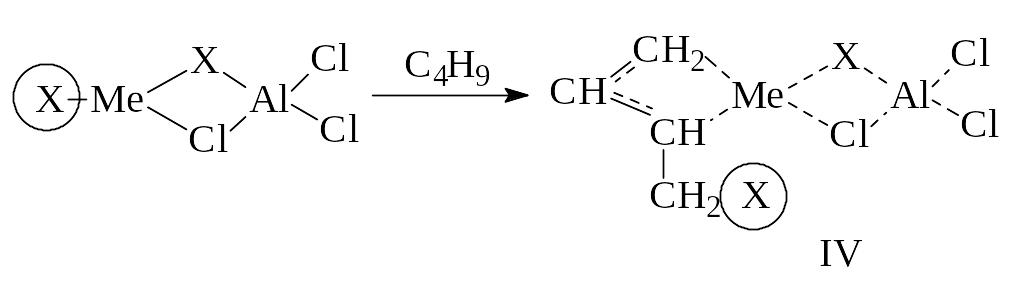
Роль кислоты Льюиса может играть металлорганические соединения алюминия – алкилалюминийдихлорид- или диалкилалюминий- хлориды. В этом случае образуются соединения, подобные типичным катализаторам Циглера – Натта:
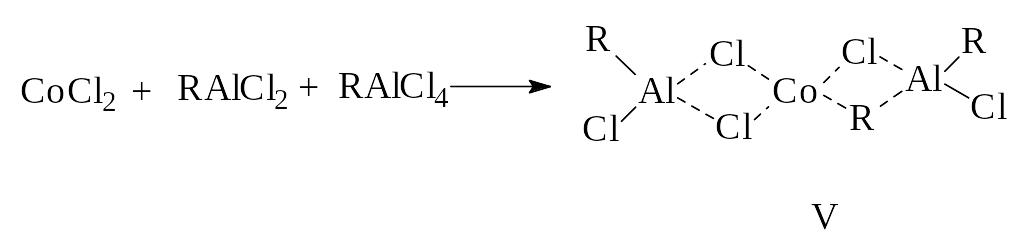
-Аллильные комплексы хрома (-С3Н7)3Cr полимеризуют бутадиен с образованием более 80 % 1,2-структур. Если в этот катализатор ввести хлороводород трихлоруксусную кислоту, то получится полимер с содержанием 1,4-цис-звеньев до 90 %.
Катализаторы Циглера – Натта
Металлорганические соединения переходных металлов известны как катализаторы полимеризации диенов и олефинов с начала 50-х годов ХХ века, когда немецкий химик К.Циглер установил возможность получения полиэтилена высокой плотности при низком давлении на комплексных соединениях титана. Изучая полимеризацию пропилена на подобных катализаторах, итальянский ученый Дж.Натта открыл стереоспецифичность их действия.
В основе синтеза катализаторов Циглера – Натта лежит взаимодействие галогенидов переходных металлов с металлорганическими соединениями. Типичными катализаторами Циглера – Натта являются двухкомпонентные комплексы, образованные при взаимодействии алкильных соединений алюминия (реже бериллия, магния, цинка) с галогенидами переходных металлов.
По механизму действия катализаторов Циглера – Натта существуют три обобщения:
- При взаимодействии компонентов катализатора происходит алкилирование иона переходного металла. Образующиеся алкильные производные переходного металла способны координировать ионы мономера.
-. Координация молекулы мономера происходит около атома переходного металла с образованием координационной связи между ними.
- Процесс полимеризации протекает путем внедрения координированной молекулы мономера между переходным металлом и последним звеном растущей полимерной молекулы.
Характер взаимодействия компонентов каталитического комплекса можно рассмотреть на примере простейшей системы триэтилалюминий – тетрахлорид титана, применяемой для полимеризации этилена. При смешении этих компонентов в углеводородной среде при температуре порядка -80С образуется растворимый, окрашенный в красный цвет комплекс, в котором титан четырехвалентен. При повышении температуры до -30С и выше происходит восстановление титана до трехвалентного, сопровождающееся выпадением осадка и выделением продуктов диспропорционирования алкильных групп алюминия - этана и этилена. Этан выделяется в количестве, соответствующем протекающей реакции, а этилена всегда образуется всегда меньше расчетного количества, по-видимому, в результате его полимеризации.
Схема взаимодействия TiCl4 и (i-C4H9)3Al в растворе:

Трихлорид титана составляет основу кристаллической решетки образовавшегося катализатора, а диизобутилалюминийхлорид распределен между раствором и осадком, с поверхностью которого он связан в виде комплексов II и IIа.
Образовавшийся диизобутилалюминийхлорид способен взаимодействовать с галогенидами титана:
(i-C4H9)2AlCl + TiCl4 → (i-C4H9)2AlCl2 + TiCl3 + 1/2(i-C4H8) + 1/2(i-C4H10)
В определенных условиях изобутилалюминийдихлорид также может восстанавливать TiCl4.
