
- •Получение пероксида водорода
- •Химические свойства пероксида водорода
- •Применение пероксида
- •Вопрос 2
- •Изотопы кислорода
- •Нахождение в природе
- •Молекула кислорода
- •Аллотропные модификации
- •Получение кислорода
- •Химические свойства кислорода
- •Химические свойства йода
- •Фториды металлов
- •Восстановительные свойства
- •Получение
- •Йодная кислота
- •Получение
- •Получение
- •Получается действием h2so4 на её соли:
- •Вопрос №8
- •Химические свойства
- •Вопрос №9
- •Взаимодействие галогенов с водой
- •Вопрос№11
- •Химические свойства н2э.
- •Получение
- •Сульфиды металлов.
- •Вопрос№12
- •Для серной кислоты характерно образование двойных солей, называе-
- •Концентрированная серная кислота в обычных условиях пассивирует
- •Круговорот азота в природе
- •Вопрос 15
- •Нахождение в природе
- •Вопрос№16
- •Nh2oh — гидроксиламин
- •В промышленности азотную кислоту синтезируют в три этапа:
- •Вопрос 18
- •Фосфиты
- •Галогениды фосфора
- •Вопрос №20
Получается действием h2so4 на её соли:
5Ba(IO3)2 = Ba5(IO6)2 + 4I2 + 9O2;
Ba5(IO6)2 + 5H2SO4 = 5BaSO4↓ + 2H5IO6
В растворах периодатов имеют место равновесия:
(IO6)5− + 2H+ = (IO5)3− + H2O; (кислая среда
(IO5)3− + 2H+ = IO4− + H2O; кислая среда
2IO4− + H2O = (I2O9) 4− + 2H+ щелочная среда
В зависимости от условий (концентрация, рН) образуются соли, содержащие (IO6)5−, (IO5)3−, IO4−, (I2O9)4- орто-, мезо-, мета- и дипериодаты соответственно
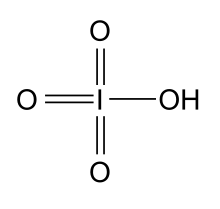
Кислотные свойства НIO4 выражены несравненно слабее, чем у HClO4, в то время, как она проявляет более сильные окислительные свойства(E0(HIO4/HIO3) = 1,64 В.). Отвечающий ей ангидрид неизвестен. При нагревании НIO4разлагается по уравнению:
НIO4 → Н2О + I2O5 + О2
Вопрос №8
Это соединения галогена с галогеном. В МГС наиболее электроотрицательный элемент принимает с.о. -1 а наименее +n
Межгалогенные соединения делят на фториды, хлориды и бромиды галогенов: ClF3, BrF5, IF7, BrCl,ICl3, IBr и т.д.
Получают их прямым синтезом:
Br2 + С12 = 2 BrС1
Br2 + 5 F2 = 2 BrF5
Или по таким реакциям
F2 + ClF = ClF3
либо с помощью процессов вида
NaГi+ (Гj)2 = NaГj+ Гi Гj
Межгалогенные соединения подвергаются гидролизу, в результате кото-
рого образуются устойчивые в водных растворах соединения:
BrС1 + Н2О → НС1 + Н BrО
BrF5 + 3 Н2О → 5 НF + Н BrО3
Межгалогенные соединения являются сильными окислителями по отно-
шению к разнообразным неорганическим и органическим веществам.
При гидролизе соединений Г+3
образуется смесь продуктов, содержащих Г− и Г+5:
3I+3Cl3− + 6H2O = 9HCl− + HI− + 2HI+5O3
IF7 + 6Н2О → 7HF + H5IO6
Химические свойства
Наиб. устойчивы моногалогениды XY (кроме фторидов Вr и I). В жидкой фазе межгалогенные соединения подвергаются частичной самоионизации. По хим. св-вам они близки к галогенам
Раств. в орг. р-рителях. Моногалогениды раств. в AsCl3, SO2, SOC12, ледяной уксусной к-те.
Межгалогенные соединения могут быть донорами или акцепторами галогенид-ионов. С галогенидами щелочных металлов образуют соли с анионами BrCl-2, ICl-2, IBr-2, ICl-4, I2Cl-3, напр.:
![]()
Способность к разложению
2ICl3= 2ICl + Cl2
Образование солей
ClF+ CsF= Cs[ClF2]
Галогенирование
W + 6ClF = WF6+ 3Cl2
2Co3O4+ 6ClF3= 6CoF3+ 3Cl2+ 4O25
Автоионизация
2BrF3(ж) ⇔BrF2+ + BrF4-
BrF3+ AsF5= [BrF2+][AsF6-]основание
NOF + BrF3= [NO+][BrF4-]кислота
Вопрос №9
Галогены, восстанавливаясь, приобретают степень окисления –1, причем от фтора к йоду их окислительные свойства ослабевают (F2 имеет ограниченное применение вследствие высокой агрессивности):
2H2O + 2F2 = O2+ 4HF
Кислородсодержащие кислоты галогенов и их соли часто используются как окислители, хотя многие из них проявляют двойственный характер. Как правило, продуктами восстановления этих соединений являются хлориды и бромиды, а также йод:
MnS + 4HСlO = MnSO4 + 4HCl;
5Na2SO3 + 2HIO3 = 5Na2SO4 + I2 + H2O
Часто используемые как окислители, галогены под действием более сильных окислителей проявляют восстановительные свойства (за исключением фтора). Их окислительные способности уменьшаются, а восстановительные способности увеличиваются от Cl2 к I2. Эту особенность иллюстрирует реакция окисления йода хлором в водном растворе:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Кислородсодержащие кислоты галогенов и их соли, в состав молекул которых входит галоген в промежуточной степени окисления, могут выступать не только в роли окислителей: S + NaClO2 = NaCl + SO2(нагревание)
но и восстановителей:
5NaClO2 + 2KMnO4 + 3H2SO4 (разб ) = 5NaClO3 + 2MnSO4 + 3H2O+K2SO4
Все кислоты более сильные окислители, чем их соли
ClO4-+ 2H++ 2e-= ClO3-+ H2O pH=0,
ClO4-+ H2O + 2e-= ClO3-+ 2OH- pH=14,
HClO4+ H2SO4+ 2FeSO4= HClO3+ H2O + Fe2(SO4)3
При pH=0 X+ и Cl3+ склонны к диспропорционированию при рН=14 диспропорционируют Х2 самая устойчивая с.о. +5
2HClO2=HClO3+ HClO
3NaClO = NaClO3+ 2NaCl(при60 0С)
Только HClO4 существует в чистом виде и не является окислителем в воном растворе
В с.о. +7 производные брома самые сильные окислители
И при рН=0, и при рН=14
В с.о. +5 окислительная способность меняется по ряду
Cl≈Br > I
2KBrO3+ I2= 2KIO3+ Br2
2KClO3+ I2= 2KIO3+ Cl2
