
Лабораторна робота №1 кристалізація металів та проведення термічного аналізу сплаву Sn-Pb
1.1 Мета роботи: вивчення процесу кристалізації солі тіосульфату натрію за допомогою біологічного мікроскопу і проектору та методом термічного аналізу визначити температуру кристалізації сплаву, користуючись правилом відрізків визначити невідомий склад сплаву Sn-Pb.
1.2 Теоретичні відомості
Метали мають специфічні властивості: високу електропровідність і теплопровідність, металевий блиск, високу міцність і ковкість.
Наявність вільних електронів обумовлює високу електро- і теплопровідність металів і металевих сплавів.
Усі метали і металеві спливи є кристалічні тіла. На відзнаку від аморфних тіл в кристалічному тілі атоми (точніше, позитивні іони) розташовуються в строго певному порядку і в просторі утворюють кристалічну гратку.
Елементарною кристалічною коміркою називається такий найменший об'єм, який дає нам уявлення про взаємне розташування атомів у всьому кристалі. В кристалографії розглядають 14 типів елементарних комірок, Переважна більшість металів має одну з елементарних кристалічних комірок: кубічну об'ємоцентровану (ОЦК), кубічну гранецентровану (ГЦК), гексагональну щільноукладену (ГПУ) , тетрагональну (рисунок1.1)
Будова і властивості кристалічних ґраток характеризується наступними параметрами:
1)періодом кристалічної комірки а, b, с - відстаню між центрами сусідніх атомів, які знаходяться в вузлах кристалічної гратки;
2)координаційним числом, яке показує, скільки атомів знаходиться на найбільш близькій і однаковій відстані від будь якого атома;
3)базисом кристалічної гратки - числом атомів, які знаходяться в одній елементарній комірці.

а - об'ємноцентрована кубічна; б - гранецентрована кубічна; в - гексагональна щільно укладена
Рисунок 1.1 - Основні типи елементарних кристалічних комірок
Правильне розташування атомів в монокристалах обумовлює неоднакову щільність заповнення атомами різних кристалографічних площин і напрямків. Властивості монокристалів залежать від вибраного напрямку, тобто від того, як щільно розташовані атоми в напрямку, вздовж котрого ведеться вимір.
В аморфних тілах властивості не залежать від напрямку, такі тіла називаються ізотропними.
Кристалічні тіла анізотропні, тобто їх властивості залежать від кристалографічного напрямку.
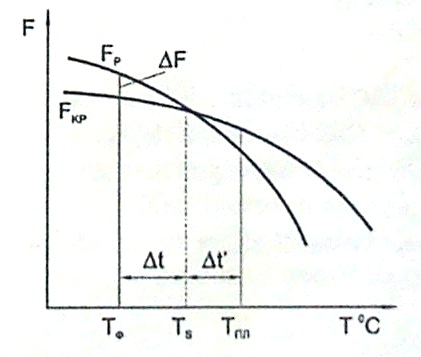
Рисунок 1.2 - Графік зміни вільної енергії F рідкого і твердого
станів залежності від температури.
Кристалізація металів - це процес термодинамічний, самостійно протікаючий згідно з другім законом термодинаміки (система прямує до мінімізації надлишкової енергії) (рисунок 1.2).
Fp
- надлишкова енергія рідини; Fкр.
-
надлишкова енергія кристалічного
стану речовини; Тs
- теоретична температура кристалізації;
Тф
-
фактична температура кристалізації;
![]() t
- температура переохолодження.
t
- температура переохолодження.
Кристалізація можлива тільки при переохолодженні рідкого металу. Це пов'язано з закономірностями надлишкової енергії в рідкому стані і твердому стані в залежності від температури.
При Тф Fкр. < Fp, тому речовина знаходиться у твердому стані; при температурі більш Тs Fкр. > Fp, тому речовина знаходиться у рідкому стані.
Із графіку також видно: чим більше значення t, тим більше різниця Fкр. – Fp, тим інтенсивніше протікає перехід речовини з рідкого в твердий стан.
Кристалізація - процес дифузійного переходу атомів (молекул) з рідини в кристалічний стан.
Механізм кристалізації складається з двох одночаснсицр'отікаючих процесів: процесу утворення центрів кристалізації (ц.к.) і процесу росту кристалів (р.к.).
Процес кристалізації вивчають за кривими охолодження (рисунок 1.3). Зниження температури викликає охолодження розплаву (ділянка ав). Процес кристалізації починається при температурі Ткр., яка менше від температури Тs на величину температури переохолодження t.
З початком кристалізації відвід тепла в навколишнє середовище буде компенсуватися виділенням схованої теплоти плавлення. На кривій охолодження з'явиться горизонтальна ділянка (ВС). При завершенні процесу кристалізації (крапка С) почнеться охолодження твердого металу (СД).
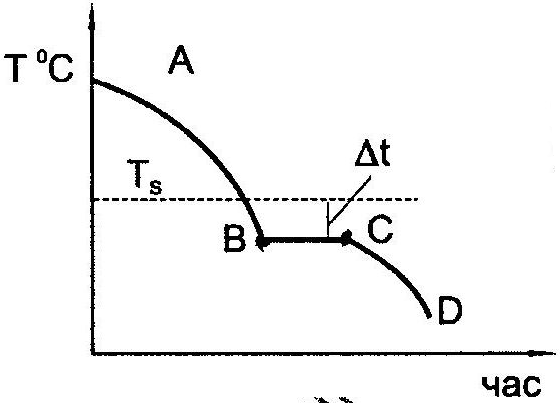
Рисунок 1.3 - Крива охолодження чистого металу
Збільшення температури переохолодження ( t) викликає збільшення центрів кристалізації і швидкості росту кристалів. Здрібнювання зерна в сплавах досягається шляхом модифікування, тобто введення в розплав дисперсних частинок, які грають роль додаткових центрів кристалізації.
При кристалізації металів і їх сплавів утворюються дендритні кристали (деревоподібні).
Діаграма стану сплаву показує зміну стану в залежності від температури і концентрації. Діаграма стану будується за результатами термічного аналізу кривих охолодження. За кривими охолодження в місцях перегину визначають температури ліквідус (початок кристалізації) солідус (кінець кристалізації). Будують криві охолодження для декількох составів сплавів. Креслять діаграму в координатах Т°С - концентрацій. На осі концентрації у точках, що відповідають вибраним сплавам, проводять температурні вертикалі. На вертикалях відкладають точки 1 і s. З'єднують точки і одержують лінії ліквідус і солідус.
Діаграма стану сплаву Sn-Pb (рисунок 3.1) відповідає діаграмі ІІІ-го роду: компоненти, необмежено розчиняються у рідкому стані, частково - у твердому і утворюють евтектику. Сплави Sn-Pb використовуються як м'які припої. Температура плавлення РЬ складає 327°С, Sn - 232°С, температура плавлення евтектики - 183°С, склад евтектики: 61,9% Sn, 32,1% Pb. Pb і Sn утворюють тверді розчини.
Користуючись діаграмою стану, визначають склад припою, температуру пайки. При пайці припої рекомендується нагрівати на 35...90°С вище температури плавлення з метою отримання необхідної рідиннотекучості і змочування.
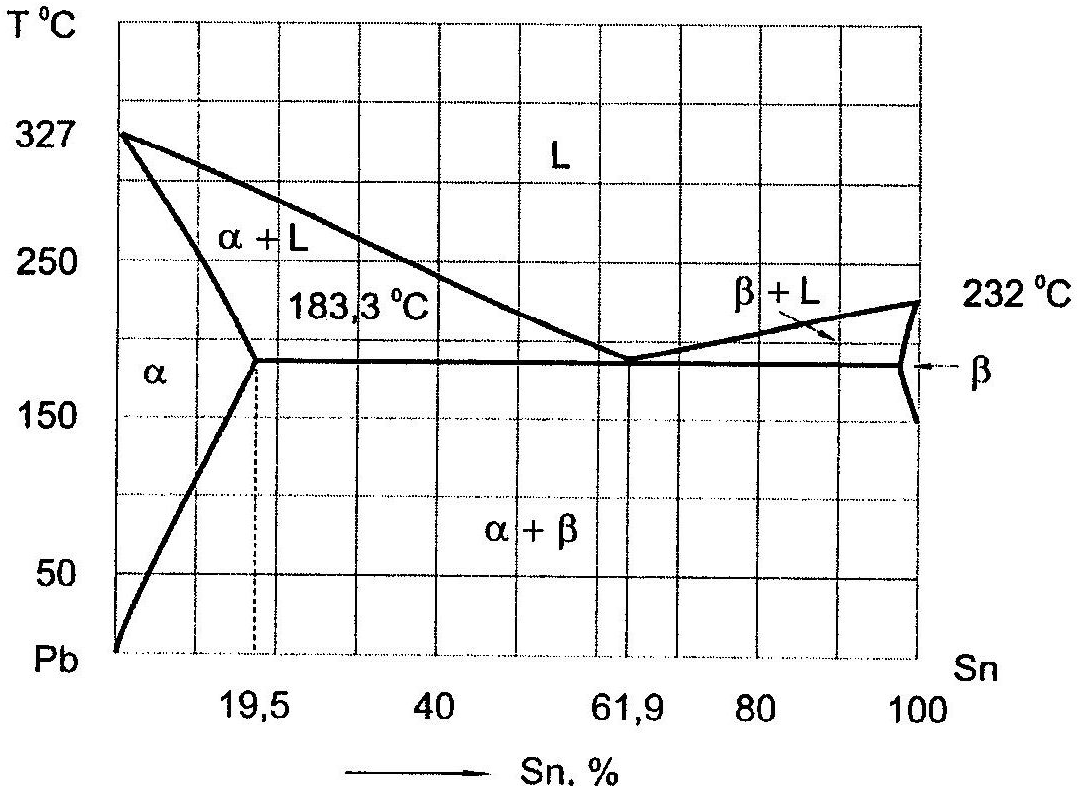
Рисунок 3.1 – Діаграма стану сплаву Pb- Sn
