
- •Введение.
- •Глава 1. Термодинамика.
- •§ 1. Исходные понятия и постулаты тд.
- •§ 2. I начало тд. Теплоемкости.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •§ 3. Применение I начала тд к равновесным процессам в идеальных газах.
- •§ 4. Обратимые процессы. Циклические процессы. Цикл Карно. Теоремы Карно.
- •§ 5. Второе начало тд.
- •§ 6. Энтропия. Свободная энергия. Энтальпия.
- •I.) Энтропия.
- •II.) Энтальпия.
- •III.) Свободная энергия.
- •§ 7. III начало тд.
- •§ 8. Термодинамические потенциалы. Метод термодинамических потенциалов.
- •§ 9. Условия равновесия и устойчивости систем.
- •7. Условие равновесия изолированной двухфазной однокомпонентной системы.
Глава 1. Термодинамика.
§ 1. Исходные понятия и постулаты тд.
Термодинамика – учение о связи и взаимопревращении различных видов энергии, теплоты и работы.
ТД изучает макросистемы – термодинамические системы – пространственные размеры которых и время существования достаточны для проведения нормальных процессов измерения. Изучает свойства макроскопических систем, которые находится в состоянии термодинамического равновесия и закономерности при их приближении к равновесию.
Макросистемы состоят из большого числа материальных частиц (например молекул, атомов, электронов и т.д.) или полей, например электромагнитного поля.
Состояние
макросистемы характеризуется
макроскопическими параметрами. Такими
как: плотность
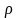 ,
объем
,
объем
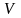 ,
упругость, давление
,
упругость, давление
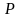 ,
температура
,
температура
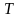 ,
внутренняя энергия
,
внутренняя энергия
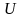 ,
концентрация, поляризация, намагничивание
и другими переменными величинами,
численные значения которых можно
измерить.
,
концентрация, поляризация, намагничивание
и другими переменными величинами,
численные значения которых можно
измерить.
Параметры подразделяются на внешние и внутренние, это зависит в каждом конкретном случае от того где проведена граница между системой и средой.
Внешние параметры – определяются положением не входящих в систему тел (например, ими могут быть , , …). Внешние параметры являются функциями координат внешних тел.
Внутренние параметры – определяются движением частиц системы ( , , ими могут быть , ), а также значением внешних параметров. Внутренние параметры системы разделяются на интенсивные параметры и экстенсивные параметры. Интенсивными называются параметры, не зависящие от массы или числа частиц в системе (давление, температура). Экстенсивными или аддитивными называются параметры пропорциональные массе или числу частиц в системе (энергия, энтропия).
В зависимости от условий, в которых находится система, одна и та же величина может быть как внешним, так и внутренним параметром.
Например, при фиксированном положении стенок сосуда объем является внешним параметром, а давление - внутренним параметром, так как зависит от координат и импульсов частиц системы. В условиях же когда система находится в сосуде с подвижным поршнем под постоянным давлением, давление будет внешним параметром, а объем - внутренним параметром, так как зависит от положения и движения частиц.
Совокупность независимых макроскопических параметров определяет состояние системы.
Состояние системы называется стационарным, если параметры системы не изменяются со временем. Состояние системы называется равновесным, если, кроме того, нет стационарных потоков извне (потоков вещества, потоков энергии).
Если состояние системы стационарное и равновесное, то говорят, что система находится в состоянии термодинамического равновесия.
В состоянии термодинамического равновесия система характеризуются как определенными значениями равновесных параметров, так и специальными термодинамическими параметрами, которые при отсутствии равновесия в системе лишены смысла для всей системы (энтропия).
Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным.
Энергия – общая мера всех простых форм движения материи (механического, теплового, электромагнитного) при их превращении одной в другую.
Система не обменивающаяся с внешней средой ни веществом ни энергией называется изолированной.
Термодинамический контакт - одна система совершает работ над другой (мех. вз.)
- одна система передает другой теплоту (тепл. вз.)
- одна система передает другой вещество (матер. вз.)
ТД процессом называется всякое изменение хотя бы одного из ТД параметров. ТД процесс – переход системы из одного состояния в другое. Такой процесс всегда связан с нарушением равновесия системы. Нарушением тем значительнее, чем быстрее идет переход. В пределе при бесконечно медленном переходе в каждый определенный момент времени система будет иметь определенные значения параметров и таким образом состояние все время будет равновесным.
Бесконечно медленный процесс, который состоит из последовательности равновесных состояний, называется равновесный квазистатический процесс.
ТД базируется на 2 постулатах и 3 началах.
I постулат ТД: всякая изолированная макросистема с течением времени приходит в состояние ТД равновесия, и самопроизвольно выйти из него не может.
II постулат ТД: все равновесные внутренние параметры являются функциями внешних параметров и температуры.
I начало ТД: говорит о том, что энергия сохраняется, оно обобщает закон сохранения энергии для макросистем, для молекулярных форм движения вещества.
II начало ТД: устанавливает наличие в природе фундаментальной ассиметрии, однонаправленности всех происходящих в ней самопроизвольных процессов. Горячие тела охлаждаются, а холодные не становятся нагретыми. Прыгающий мяч останавливается, а покоящийся самопроизвольно не подскакивает. Здесь проявляется свойство природы, что хотя полное количество энергии должно сохраниться в любом процессе, распределение имеющейся энергии изменяется необратимым образом.
III начало ТД: утверждает невозможность охлаждения вещества до температуры абсолютного нуля. Оно очевидным образом предполагает атомное строение вещества.
Второй постулат ТД приводит к существованию функциональных соотношений, называемых уравнения состояния, устанавливающих связь между внешними параметрами, температурой и каким-либо внутренним параметром состояния макросистемы. Т.е. параметры системы не могут принимать произвольное значение. Для любой системы они связаны некоторым функциональным соотношением.
Если этим внутренним параметром является внутренняя энергия , то уравнение называется калорическим уравнением состояния.
Если внутренним параметром является какая-либо обобщенная сила, то уравнение называется термическим уравнение состояния.
Общее число термических и калорического уравнений состояния системы равно числу ее степеней свободы, т.е. числу независимых параметров, характеризующих состояние системы. Если все эти уравнения состояния известны, то с помощью начал термодинамики можно определить все термодинамические свойства системы.
Вывести сами уравнения состояния на основе начал ТД нельзя. Для каждой конкретной системы они определяются эмпирически, т.е. берутся из опыта, или находятся методами статистической физики. Так что в рамках ТД они считаются заданными при определении системы.
До сих пор не существует удовлетворительной общей теории уравнений состояния, кроме случаев особых простых систем: идеального газа и совершенных кристаллов. Для жидкостей и твердых тел соотношения между параметрами состояния до сих пор получают эмпирически.
Ограничимся рассмотрением простых систем, систем с постоянным числом частиц, состояние которых определяется только одним внешним параметром и температурой.
Термическое уравнение состояния такой системы, записанное в общем виде:
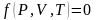 .
.
Калорическое уравнение состояния, записанное в общем виде:
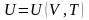 .
.
Например:
для
идеального газа уравнение состояния
(термическое) - это уравнение
Менделеева-Клапейрона
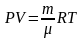 ;
;
для модели реального газа уравнение состояния - это уравнение Ван-дер-Ваальса
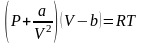 -
для одного моля вещества.
-
для одного моля вещества.
Если известны два параметра, то третий находится из уравнения состояния
.
Например:
 ,
,
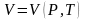 ,
,
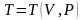 .
.
Уравнение состояния изображается в условном пространстве , , поверхностью состояний. Каждой точке такой поверхности соответствует определенное состояние данной системы, и наоборот, точке не лежащей на поверхности не соответствует никакое состояние этой системы. Если мы отметим точками на поверхности состояний, все промежуточные состояния, в которых будет находиться система при совершении квазистатического процесса перехода из начального состояния в некоторое конечное состояние, то, полученная линия, отразит путь перехода от начального состояния в конечное. Таких путей перехода может быть бесконечное множество.
В ряду параметров выделяются величины, которые так же характеризуют состояние системы и меняются с изменением состояния, т.е. зависят от , , . Но эти величины, зависят только от состояния, и, не зависят от того пути, по которому система пришла в это состояние. Они дают более полные сведения о системе и называются функциями состояния.
Величины, независящие от предыстории, а полностью определяющие состояние системы в данный момент называются функциями состояния, т.е. функциями , , .
