
- •Введение.
- •Глава 1. Термодинамика.
- •§ 1. Исходные понятия и постулаты тд.
- •§ 2. I начало тд. Теплоемкости.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •§ 3. Применение I начала тд к равновесным процессам в идеальных газах.
- •§ 4. Обратимые процессы. Циклические процессы. Цикл Карно. Теоремы Карно.
- •§ 5. Второе начало тд.
- •§ 6. Энтропия. Свободная энергия. Энтальпия.
- •I.) Энтропия.
- •II.) Энтальпия.
- •III.) Свободная энергия.
- •§ 7. III начало тд.
- •§ 8. Термодинамические потенциалы. Метод термодинамических потенциалов.
- •§ 9. Условия равновесия и устойчивости систем.
- •7. Условие равновесия изолированной двухфазной однокомпонентной системы.
Введение.
Предметом ТД и СтФ является изучение молекулярной формы движения вещества, т.е. движения больших совокупностей частиц, а именно молекул. Это науки о строении, физических свойствах, и агрегатных состояниях вещества, рассматриваемого как совокупность большого числа молекул, которые взаимодействуют между собой и находятся в тепловом движении. Макроскопические свойства вещества, которые изучаются ТД и СтФ считаются независимыми от внутреннего состояния.
Молекула – это наименьшая часть вещества, сохраняющая все его свойства.
Тепловое движение – беспорядочное хаотическое движение, не имеющее какого-либо преимущественного направления. Интенсивность движения зависит от температуры тела.
Задачи ТД и СтФ:
Изучение особенностей молекулярной формы движения самой по себе, а именно: исследование строения вещества и его изменение под влиянием внешних воздействий; изучение явлений переноса – диффузии, теплопроводности, внутреннего трения; исследование критических состояний вещества; исследование поверхностных явлений на границе раздела фаз вещества.
Овладение методами изучения систем многих частиц (не обязательно молекул), а именно динамическим, термодинамическим и статистическим методами и соответствующими понятиями. Отработка и развитие этих методов.
Изучая строение и свойства окружающего нас мира, мы используем опыт, как инструмент познания. Количественное описание нам помогают делать абстрактные модели изучаемого предмета, или какого-либо его свойства. Эти модели не учитывают другие свойства предмета, не существенные в данном конкретном случае.
В механике мы рассматривали движение материальных тел, свойства которых были представлены в виде моделей материальной точки и абсолютно твердого тела. В расчет не принимались внутренняя структура и пространственная протяженность материального тела, не исследовались внутренние свойства и внутреннее движение материальных тел. Эти модели не применимы для изучения внутренних свойств материальных тел, когда существенны их структура и движение частей тела относительно друг друга
ТД и Молекулярная физика предлагают другие модели:
Материальные тела состоят из большого числа взаимодействующих частиц (атомов и молекул), причем известно строение атомов и молекул.
Частицы взаимодействуют по некоторым законам и соответствующим образом движутся.
Сами атомы и молекулы так же могут быть представлены некоторыми моделями, в зависимости от характера рассматриваемого явления. Например, моделью материальной точки, абсолютно твердого тела или моделью учитывающей внутреннюю структуру атомов или молекул.
Взаимодействие и движение так же можно рассматривать или чисто классически, или учитывать квантовые закономерности при движении микрочастиц.
Одним из примеров модели материального тела является модель идеального газа. По определению он состоит из точечных частиц с конечной массой, которые не взаимодействуют между собой. Частицы сталкиваются по законам абсолютно упругого удара, по законам соударения шаров. Так как точечные частицы испытывают только лобовые столкновения, приводящие к изменению их скоростей на обратные. Лобовые столкновения не изменяют скоростей частиц, на какие либо другие углы.
Наиболее близко свойствам идеального газа соответствую разреженные газы и газы при нормальных условиях.
Простота модели идеального газа делает ее удобной для ознакомления с методами изучения систем многих частиц и соответствующими понятиями.
Динамический метод – метод механики.
Между столкновениями частицы движутся по прямым линиям. Известны законы столкновений и ударов о стенки сосуда, поэтому, зная положения и скорости частиц в настоящее время, можно вычислить их положения и скорости во все последующие моменты времени. Положение частиц и скорости частиц дают наиболее полную и детальную картину и информацию о системе частиц.
Но
эту информацию невозможно обработать
даже на самом современном компьютере,
т.к. при нормальных условиях (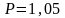 кПа,
кПа,
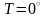 С)
в
С)
в
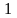 м3
воздуха содержится примерно
м3
воздуха содержится примерно
 молекул. Это означает, что для записи в
настоящий момент времени положений и
скоростей частиц потребуется зафиксировать
молекул. Это означает, что для записи в
настоящий момент времени положений и
скоростей частиц потребуется зафиксировать
 чисел (координаты и проекции импульсов
каждой частицы). Но и сама информация
об отдельных частицах непригодна для
теоретического анализа.
чисел (координаты и проекции импульсов
каждой частицы). Но и сама информация
об отдельных частицах непригодна для
теоретического анализа.
Таким образом, динамическое описание системы многих частиц неосуществимо с технической, непригодно с теоретической и бесполезно с практической точек зрения.
Статистический
метод
– основан на вероятностных представлениях
и на том, что свойства макросистем,
определяются свойствами частиц, входящих
в системы, особенностями их движения и
усредненными
значениями
динамических характеристик этих частиц
(скоростей и энергий). Усреднение
проводится по большим группам частиц,
т.е. то что мешало в работе по первому
методу, помогает во втором методе. Ибо
чем больше частиц, тем более обосновано
пользование средними характеристиками.
Усреднение характеристик идет по порядку
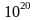 .
Усредненные величины подчиняются
статистическим
закономерностям,
которые и устанавливаются с помощью
данного метода. Законы поведения
совокупностей большого числа частиц
называется статистическими
закономерностями.
.
Усредненные величины подчиняются
статистическим
закономерностям,
которые и устанавливаются с помощью
данного метода. Законы поведения
совокупностей большого числа частиц
называется статистическими
закономерностями.
Например, температура тела определяется средней кинетической энергией поступательного движения частиц тела (системы), т.е. скоростью беспорядочного движения его молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то скорость может быть выражена только через среднее значение скоростей движения молекул. Нельзя говорить о температуре одной молекулы.
Таким образом, макроскопические характеристики тел имеют смысл лишь в случае большого числа молекул.
Статистический метод позволяет понять суть явления, установить связь поведения системы в целом с поведением и свойствами отдельных частиц системы или подсистем.
Термодинамический метод – идет по другому пути, абстрагируется от внутреннего строения системы, не интересуется внутренними механизмами процессов, определяющих поведение изучаемой системы в целом, и оперирует только характеристиками, относящимися к системе в целом. Наблюдаемыми характеристиками. Например, модель идеального газа в состоянии равновесия при таком подходе характеризуется объемом, давлением и температурой. Это феноменологическая теория, т.е. теория, опирающаяся на опытные данные, идущая от явления. Экспериментальные исследования призваны установить связи между величинами, а теория стоится на некоторых общих положениях, началах, (например, на законе сохранения энергии), и с их помощью объясняет эти связи.
Общие положения такой теории постулируются, а выводы применяются и в других смежных дисциплинах, например, физической химии.
Благодаря простоте логических построений термодинамический метод часто позволяет с очень общих позиций разобраться в сути явлений.
Статистический и термодинамический методы изучения систем многих частиц дополняют друг друга. Их комбинированное применение способствует наиболее эффективному решению той или иной научной проблемы.
Термодинамика и Статистическая физика, изучая один и тот же предмет, отличаются друг от друга лишь методами его исследования. Но только статистическая интерпретация термодинамических понятий и законов (температуры, первого и второго начал, энтропии) делает их наглядными и конструктивными, и определяет границы из применимости.
ТД и СтФ, изучая системы многих частиц, количество вещества характеризуют числом его структурных элементов. В системе СИ количество вещества выражается в молях.
Моль
равен количеству вещества рассматриваемой
системы, которое содержит столько же
структурных элементов, сколько структурных
элементов (атомов) содержится в 0,012 кг
изотопа углерода
 .
.
Таким
образом, моль любого вещества содержит,
по определению, одинаковое число
структурных элементов. Это число называют
постоянной
Авогадро
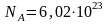 моль-1.
моль-1.
Понятие моля относится к числу структурных элементов вещества, поэтому они всегда должны быть указаны, иначе определение теряет смысл. Например, в сосуде содержится 1 моль молекул воды.
ТД
и СтФ также пользуются понятием молярной
массы, которая определяется как масса
1 моль вещества:
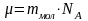 .
.
Число
молей вещества связано с числом молекул
вещества
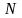 :
:
 ,
или
,
или
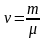 .
.
