
- •21 Загальна х-ка процесу розсіювання високоенергетичних електронів у тв. Тілі
- •22 Відбиті та вторинні електрони
- •23 Будова рем
- •24 Основи формування зображення рем, збільшення та глибина фокусу
- •25 Детектори електронів у рем
- •Детектори сцинтилятор-фотопомножувач. Еверхарт та Торнлі
- •26 Методи обробки сигналу у рем
- •27 Поняття про ідеальне зображення. Аберації 3-го порядку Ідеальне, або гаусівське, зображення
- •28 Конструкція пем. Хід променів у колоні мікроскопа із 3-х ступеневим збільшенням Конструкція пем
- •29 Практичні режими роботи пем: дифракційний, мікродифракційний, світлопольний, темнопольний Режими роботи пем
- •30 Фізичні основи принципу роботи та конструкція скануючого тунельного мікроскопу
- •31 Основи термодинаміки і кінетичної теорії газів (рівноважний тиск металевої пари).
- •32 Основи термодинаміки і кінетичної теорії газів (розподіл атомів металевої пари за швидк).
- •33 Випаровування матеріалів для т.Плівок і покриттів: ел.-променеве, іонне, реактивне)
- •34 Методи контролю та вимірювання товщин тонких плівок.
- •35 Чотири стадії росту плівки; механізм конденсації плівок.
- •36 Утворення дефектів у процесі росту плівки і покриття (дислокації).
- •37 Утворення дефектів у процесі росту плівки і покриття (межі зерен).
- •38 Нанокристал. Та аморфні плівкові матеріали.
- •39 Внутрішні макронапруження в конденсатах.
- •40 Процеси старіння в тонких плівках.
- •1 Основні х-ки вакуумної системи. Основне р-ня вакуумної техніки.
- •2 Класифікація вакуумних насосів. Параметри і робочий діапазон дії.
- •5 Конструкція та принцип дії багатоступеневого паромасляного дифузійного насосу.
- •6 Конструкція і принцип роботи іонно-сорбційних, адсорбційних, кріогенних насосів.
- •7 Механ. Молекулярні та турбомолекул. Насоси.
- •8 Принцип роботи обертальних пластинчатих насосів. Робочі рідини для оберт. Насосів.
- •9 Розбірні вакуумні з’єднання. Гнучкі вакуумні з’єднання. Передача руху у вакуум.
- •10 Конструкція і принцип роботи вакуумних уловлювачів.
- •11 Послідовність формування та схема техн.. Процесу дифузійно-планарних імс
- •12 Послідовність формування та схема техн.. Процесу епітаксійно-планарних імс.
- •13 Послідовність формування та схема техн.. Процесу виготовлення V-канальних німс.
- •14 Послідовність формування та схема техн.. Процесу німс з діелектричною ізоляцією
- •15 Впровадження домішки у напівпровідник шляхом термічної дифузії
- •16 Впровадження домішки у напівпровідник шляхом іонної імплантації
- •17 Автоепітаксія кремнію як базовий технологічний процес виготовлення імс.
- •18 Загальна х-ка фотолітографічного процесу.
- •19 Схема технолог. Процесу виготовлення товсто плівкових гімс. Х-ка та трафаретний друк.
- •20 Загальна х-ка етапів та методів зборки імс.
31 Основи термодинаміки і кінетичної теорії газів (рівноважний тиск металевої пари).
Перехід твердого
тіла або рідини в газоподібний стан
можна описати як з макроскопічної, так
і мікроскопічної точки зору. У першому
випадку використовується термодинамічний
підхід, і розглядаються такі кількісні
характеристики, як швидкість випаровування,
взаємодія між атомами речовини, яка
випаровується, і випарника та ін. У
другому випадку опис базується на
кінетичній теорії газів, яка, між іншим,
застосовується також при розгляді
процесу відкачування газів із вакуумної
камери. Рівноважний
тиск пари. При
термодинамічному підході конденсований
або газоподібний стан речовини є функцією
таких параметрів, як тиск,
температура,
об'єм і
маса. Особливе
значення має умова термодинамічної
рівноваги (кількість атомів, які залишають
тверде тіло чи рідину, дорівнює кількості
атомів, які конденсуються знову). Всі
речовини мають певне значення тиску
насиченої пари (рн),
який залежить від температури. Тиск
насиченої пари над поверхнею сконденсованої
фази є важливою характеристикою, яка
дозволяє оцінити можливості випаровування
речовини і ті температури, при яких
досягаться необхідна швидкість
випаровування і навіть конденсації.
Залежність
![]() як відомо, дуже
добре описується рівнянням
Клапейрона-Клаузіуса. Для цього розглянемо
умову фазової рівноваги насичена пара
- тверде тіло і поняття про термодинамічний
потенціал Гіббса (Ф). Із теорії фазової
рівноваги відомо, що при незмінних
зовшшньому тиску та температурі дві
фази будуть в рівновазі, якщо виконується
умова
як відомо, дуже
добре описується рівнянням
Клапейрона-Клаузіуса. Для цього розглянемо
умову фазової рівноваги насичена пара
- тверде тіло і поняття про термодинамічний
потенціал Гіббса (Ф). Із теорії фазової
рівноваги відомо, що при незмінних
зовшшньому тиску та температурі дві
фази будуть в рівновазі, якщо виконується
умова
![]() де
де
![]() U-внутрішня
енергія; S-ентропія;
індекси п та
к поз-начають
пару і конденсовану фазу (в нашому
ви-падку - тверде тіло або рідину).
Переходячи від інтегрального співвідношення
запишемо
U-внутрішня
енергія; S-ентропія;
індекси п та
к поз-начають
пару і конденсовану фазу (в нашому
ви-падку - тверде тіло або рідину).
Переходячи від інтегрального співвідношення
запишемо
![]() або
або
![]()
![]() де
де
![]() повний
диференціал термодинамічного потенціалу
Гіббса. Тоді
повний
диференціал термодинамічного потенціалу
Гіббса. Тоді![]()
Потім![]() .
Враховуючи, що при
.
Враховуючи, що при
![]() ,
,
![]() одержимо
одержимо
![]() якщо
скористаємося рівнянням для одного
моля ідеального газу
якщо
скористаємося рівнянням для одного
моля ідеального газу
![]() .
.
![]() Після потенціювання одержуємо залежність
тиску насиченої пари від температури:
Після потенціювання одержуємо залежність
тиску насиченої пари від температури:
![]() яка підтверджується експериментально
це ілюструється на прикладі насиченої
пари алюмінію).
яка підтверджується експериментально
це ілюструється на прикладі насиченої
пари алюмінію).
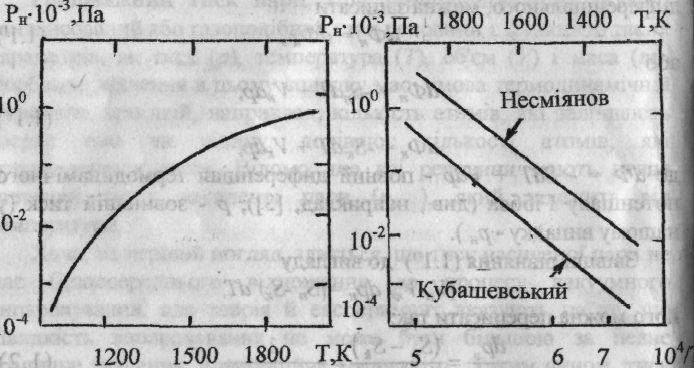
за
кутовим коефіцієнтом залежності
![]() можна
визначити величину
можна
визначити величину
![]() За даними
О.Кубашевського та О.М.Несміянова (рис.)
вона дорівнює відповідно 313 та 305 Дж/моль,
що відрізняється не суттєво, хоча
абсолютні значення
одержані цими авторами, різні.
За даними
О.Кубашевського та О.М.Несміянова (рис.)
вона дорівнює відповідно 313 та 305 Дж/моль,
що відрізняється не суттєво, хоча
абсолютні значення
одержані цими авторами, різні.
32 Основи термодинаміки і кінетичної теорії газів (розподіл атомів металевої пари за швидк).
Д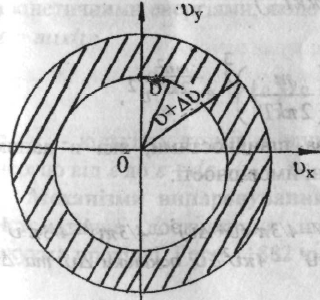 ля
того щоб одержати функцію розподілу
атомів (молекул) речовини, яка випаровується,
за швидкостями, необхідно провести такі
ж міркування, як і для газових молекул
при одержанні розподілу Максвелла. Якщо
позначити кількість атомів із одиниці
об'єму пари металу, які мають швидкість
від
ля
того щоб одержати функцію розподілу
атомів (молекул) речовини, яка випаровується,
за швидкостями, необхідно провести такі
ж міркування, як і для газових молекул
при одержанні розподілу Максвелла. Якщо
позначити кількість атомів із одиниці
об'єму пари металу, які мають швидкість
від
![]() через
через
![]() то можна записати
то можна записати
![]() де
де
![]() - поки
що невідома функція; п
- концентрація
атомів;
- поки
що невідома функція; п
- концентрація
атомів;
![]() елемент об'єму в просторі швидкостей,
який займають атоми зі швидкістю від
елемент об'єму в просторі швидкостей,
який займають атоми зі швидкістю від
![]() .
Для знаходження об'єму необхідно
розглянути в просторі швидкостей
кульовий прошарок із внутрішнім радиусом
.
Для знаходження об'єму необхідно
розглянути в просторі швидкостей
кульовий прошарок із внутрішнім радиусом
![]() і зовнішнім
і зовнішнім![]()
Із геометрії
рисунка випливає, що
![]() Підставивши і ввівши коефіцієнт
пропорційності в запишемо
Підставивши і ввівши коефіцієнт
пропорційності в запишемо
![]() Функция
Функция
![]() знахо-диться методами статистичної
фізики, і в кінцевому вигляді її можна
записати так:
знахо-диться методами статистичної
фізики, і в кінцевому вигляді її можна
записати так:
![]() де к - постійна
Больцмана; m
- маса атома.
де к - постійна
Больцмана; m
- маса атома.
Ймовірність
![]() того, що атом із металевої пари буде
мати швидкість в інтервалі
того, що атом із металевої пари буде
мати швидкість в інтервалі
![]() , можна
записати так:
, можна
записати так:
![]() Знаходиться явний вигляд коефіцієнта
пропорційності:
Знаходиться явний вигляд коефіцієнта
пропорційності:
![]() У
кінцевому вигляді розподіл Максвелла
можна записати
У
кінцевому вигляді розподіл Максвелла
можна записати
![]() або
або
![]() де
де
![]() - функція розподілу за швидкостями.
- функція розподілу за швидкостями.
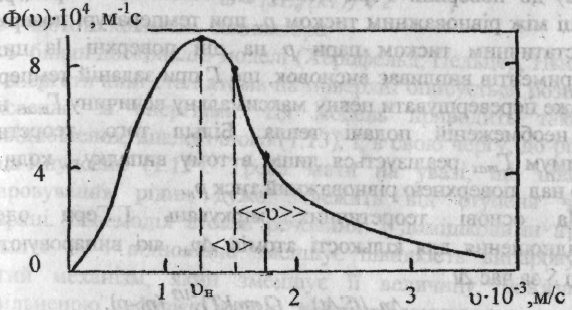 Розподіл Максвелла для атомів алюмінію
при
Розподіл Максвелла для атомів алюмінію
при
![]() найбільш
ймовірна;
найбільш
ймовірна;
![]() середня та
середня та
![]() - середня
квадратична швидкості) середньої та
середньоквадратичної швидкостей. Ці
швидкості співвідносяться між собою
так:
- середня
квадратична швидкості) середньої та
середньоквадратичної швидкостей. Ці
швидкості співвідносяться між собою
так:
![]() Від розподілу за швидкостями можна
перейти до розподілу за кінетичними
енергіями, якщо підставити
Від розподілу за швидкостями можна
перейти до розподілу за кінетичними
енергіями, якщо підставити
![]() та
та
![]()
![]() де
де
![]() - кількість
атомів в одиниці об'єму, які мають
кінетичну енергію від
- кількість
атомів в одиниці об'єму, які мають
кінетичну енергію від
![]()
