
- •Цикл Карно и его кпд.
- •Обратимые и необратимые циклы, их кпд.
- •Сопоставление кпд обратимого и необрат процессов
- •Приведенное кол-во теплоты, неравенство Клазиуса
- •2 Фазы м. Находиться при непосредственном соприкосновении, они находятся в равновесии. P,t – равновесные в данном состоянии. В равновесии м. Нах-ся не более 3х фаз.
Вопрос №1.
Термод-й и статич-й м-д изучения макросистем.
Молек-я физ-а – в основе статический м-д – изучает строение и свойства вещества исходя из молекулярно- кинетических представлений.(все тела состоят из молекул, которые всегда хаот-о движутся). При этом она пользуется вероятностными мет-ми и истолковывает свойства тел, непосредственно наблюдаемые на опыте, как суммарный, усреднённый результат действия отдельных молекул.
Термодинамика – изучает общие свойства макроскопических систем, находящихся в состоянии термодин-го равновесия, и прорцессы перехода между этими состояниями. Термод- ка не рассматр-т микропроцессы, которые лежат в основе этих превращений. Базируется на двух началах – фундоментальных законах.
У этих мет-в общий предмет изучения – св-ва вещ-ва и происходящие в них процессы.
Параметры состояния.
Длина, объем, темпер.,плотн, и др. Физ. Тело характеризуется какими-то физ. величинами, они имеют опред. ед. измерения и наз-ся параметрами.
Если параметры, хар-ие состояние системы в каждой точке одинаковы, без внешних воздействий, то такое состояние – равновесное. Переход из одного состояния в другое – термодинамический процесс.
Термодинамические функции.
Между парам-ми состояния существует определённая связь, называемая уравнением состояния: f(p, V, T) = 0.
Свойства:
1.![]()
2.В замкнутом цикле функция не изменяется.
Основные положения МКТ.
1.В-во состоит из частиц.
2.Они находятся в непрерывном движении, к-ое зависит от температуры и от агрег. сост-й вещества.
3.Молекулы взаимодействуют друг с другом.
Понятие идеального газа.
Эта модель используется при изучении свойств газов.
1.Собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда.
2. Между молекулами газа отсутствуют силы взаимодействия.
3. Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Газовые законы. Изопроцессы.
Бойля – Мариотта – изотермический процесс
P V
= const, при T = const.
V
= const, при T = const.
Шарля - изобарный
V=V0(1+αt), при P = const.
α -термич.
коэфиц-т объёма. α=1/273(1/град).
-термич.
коэфиц-т объёма. α=1/273(1/град).
Г ей – Люссака – изохорный.
P = P0(1+αt), при V = const.
Все законы при m = const.
Авагадро
Моли любых газов при одинаковых темпер-е и давл-ии занимают одинаковые объёмы. При н.у. этот V=22,41*10-3 м3/моль.
В одном моле различных веществ содержится одно и то же число молекул: NA = 6.022*1023 моль-1.
Дальтона
Давление смеси идеальных газов равно сумме парциальных давлений P1,P2,…,Pn входящих в неё газов:
P = P1+P2+….+Pn.
Парциальное давление – давление, кот-е производил бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же темпер-ре.
Уравнение Клапейрона-Менделеева.
Н еобходимо
получить связь между нач. и кон. состояниями
газа.
еобходимо
получить связь между нач. и кон. состояниями
газа.
1) P1,V1,T1; 1→1’(T1=const)
1’)P1’;V2,T1; 1’→2(V2=const)
2)P2,V2,T2.
По газ. законам:
P1V1=P1’V2
![]()
Т.о.
![]()
B – газовая постоянная.
m =
μ;V=V0;
Возьмём массу газа = 1 моль→![]()
R – универсальная газовая постоянная = 8,31 (Дж/моль*К).
Ф/с R – та работа, которую сов-т 1 моль газа при нагревании на 1 К.
Для любого объёма:
![]()
Вопрос №2.
Реальный газ.
Не,Н2. PV=RT – осн. ур-е опис. состояние идеал газа. Высокая Т и низкое Р – условие, при кот можно использовать ур-ние М-К для опис реал газов.
r~10-10м![]()
p0=1атм, Т=273 К. Na=2,7·1025м-3(число Лошмидта)
V=Nл·N0=2,7*1025*4*10-30=10-4м3
Доля суммарного объема V/1м3=0.0001
P0=3 атм, доля суммарного объема повысится в 3 раза. Молекулы реальных газов не могут сблизиться, взаим происходит на расстоянии, т.е доля суммарного объема всех молекул будет возрастать очень быстро. Это и нужно учитывать при составлении Ур. М-К. Между молекулами реал газов сущ очень сильное взаимодействие: притяжение, отталкивание. Это все обусловлено внут энергией взаимод-их ядер.
r0 – соот равновесному состоянию системы. Силы отталк. И притяжения равны.
d-мин. Расстояние до кот могут сблизиться атомы, кин энергия падает и переходит в потенциальную. Уменьшается V появл. внутр.Р. отличие реальных газов от идеальных заключ в конеч. размерах молекул газа, так что при опред условиях нельзя принебрегать суммарным объемом молекул.
Взаимодействие между молекулами, кот приводит к дополнит внутр или межмол-му давлению. Поэтому реал газ при данных условиях занимает как-бы меньший объем и находится под большим давлением
Уравнение Ван-Дер-Ваальса
PV=RT – Ур-ние М-К для идеал газов
(V-b)(P+P|)=RT, где P|-определяет взаимодействие между молекулами, b-учитывает размеры молекул
P|=a/V2, a-1ая поправка Ван-дер-Ваальса учитывающ взаимод между молекулами.
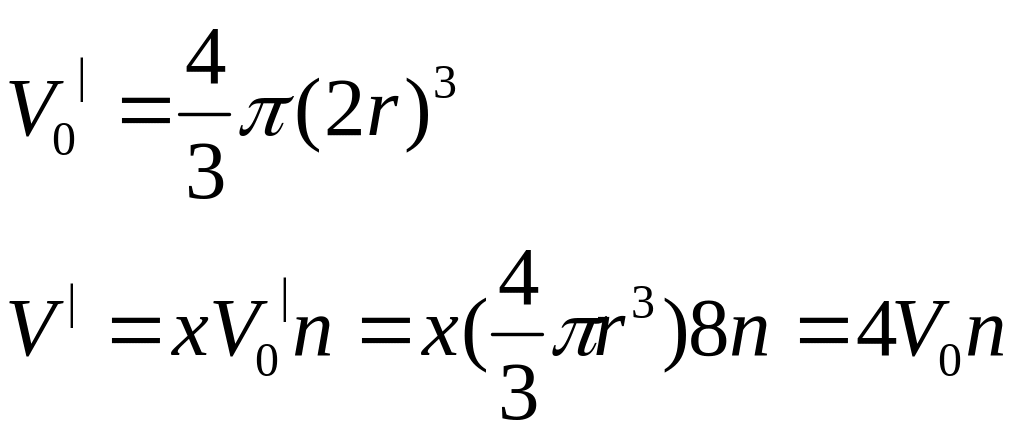
b=4V0n, b-учетверенный объем всех молекул заключ в единице объема
![]() Уравнение
В-д-В для 1 моля
Уравнение
В-д-В для 1 моля
![]()
 Уравнение
В-д-В для любого кол.
Уравнение
В-д-В для любого кол.
Изотермы Ван-Дер-Ваальса
![]()
![]()
![]()
![]()
К- критич точка, соот P и V критич. – выше идет изотерма В-д-В
Критические параметры и их связь с постоянными В-д-В
Выразим P
![]() если
К- точка перегиба, то 1-ая 2-ая произв.
Обращаются в 0.
если
К- точка перегиба, то 1-ая 2-ая произв.
Обращаются в 0.
![]()
![]()
Условие при кот-м произ=0:
V=Vkp; P=Pkp; T=Tkp
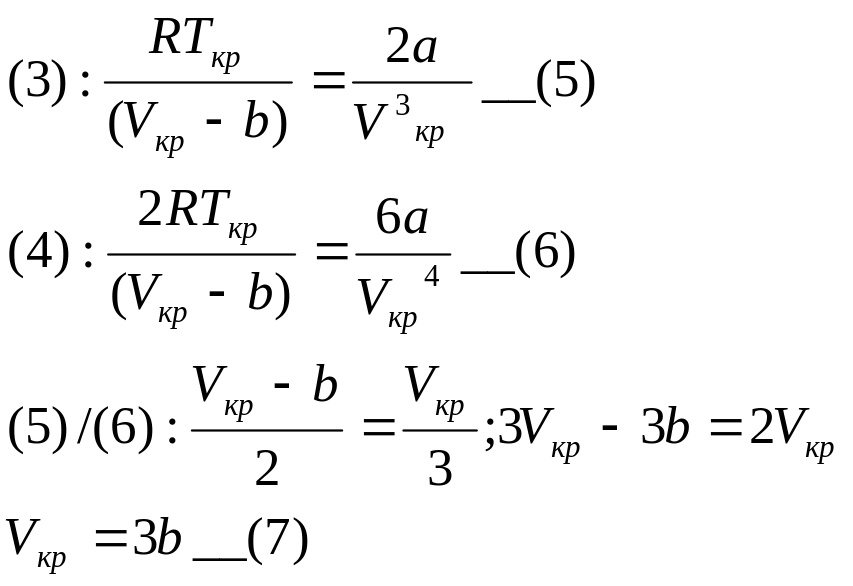
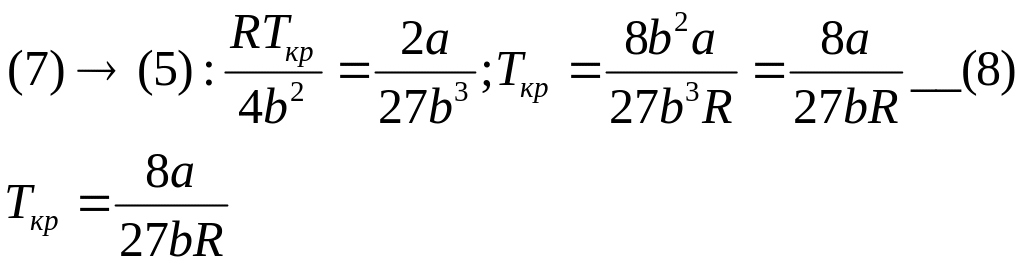
![]() __(9)
__(9)
Возьмем уравнение М-К для Крит параметров
Pkp*Vkp=RTkp;
![]()
![]() Т.е
вещество не подчиняется Ур-нию М-К
Т.е
вещество не подчиняется Ур-нию М-К
Закон соответственных состояний
Для хар-ки поведения газа важно не столько абсолютное значение параметров сост-я, сколько относительное(в долях крит пар-в)
P=Pkpπ; V=Vkpω; T=Tkpτ подставляем это в ур-ние В-д-В
(π+3/ω2)(3ω-1)=8τ
Каждому сост-ю любого газа м поставить в соот-е сост др газа.
Вопрос №3.
Понятие внутр-й энергии и температуры.
Внутр. Энергия – энергия хаот-го (теплового) движения микрочастиц системы и энергия взаимодействия этих частиц. Это однозначная функция термод-го сост-я – в каждом сост-ии сист-а обладает вполне определённой внутр-й энергией.
Температура – характ-т сост-ие термодин-го равновесия макроскоп-й системы.
Число степ-й свободы – число независимых координат, полностью определяющих положение сист-ы в простр-ве.
i=3 – поступ-е движ-е, одноат-й газ(3).
i=2 – вращат-е, двух атомн. газ (5).
i=1 – колеб-е, трёх атомн. и многоат.(6).
На одну степень свободы приходится энергии:
![]() в
общем:
в
общем:
![]()
Для N
молекул:
![]()
В ид. газе взаимная пот. эн. молекул = 0, т.о внут. эн.для 1 моля равна сумме кинет-х энергий NA молекул:
![]() -
произв. m
-
произв. m
Внут. эн. зависит только от темпер-ры.
Теплота и работа.
Газ под поршнем в цилин-м сосуде, найдём работу газа:
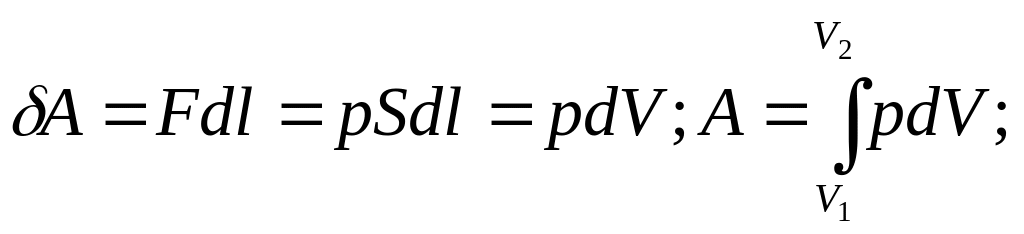
Р абота
характеризуется площадью
абота
характеризуется площадью
фигуры и зависит от способа,
которым осуществ-ся процесс.
Т.е. работа есть харак-ка процесса.
Теплота – это энергия, которой обмениваются термодин-е системы при теплообмене: dQ=CdT;
Задание dQ не определяет однозначно изменения темпер-ры, т.е. состояния системы, т.о. колич-во теплоты является функцией не состояния, а процесса.
Первый закон термодинамики.
ΔU=U2-U1;
ΔU=Q-A;Q=
ΔU+A;
![]()
Теплота, сообщаемая системе, расходуется на изменение её внутр. энергии и на совершение ею работы против внешн. сил.
Правило знаков: если сист. получает кол-во теплоты dQ, совершает работу dA или увеличивает внутр. эн. dU, то соответствующие величины считаются положительными.
Применение ПНТ к процессам в идеальном газе.
1) V=const;
dA=0; dQ=dU;
![]()
2)P=const;
dQ=dU+dA;
![]() A=p(V2-V1);
A=p(V2-V1);
ΔQ=ΔH; H=U+pV-кол-во теплоты, подводимой к системе, определяется изменением функции состояния H –энтальпия.
3)T=const; dQ=dA; P=RT/V;
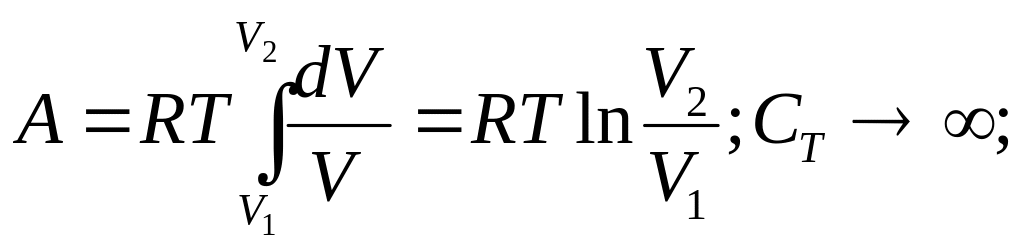
4) Адиобатный процесс (dQ=0); dA=-dU;

Ур.Пуассона: TVγ-1=const; A=CV(T1-T2);
dA=-dU; U=CVT → dU=CVdT;
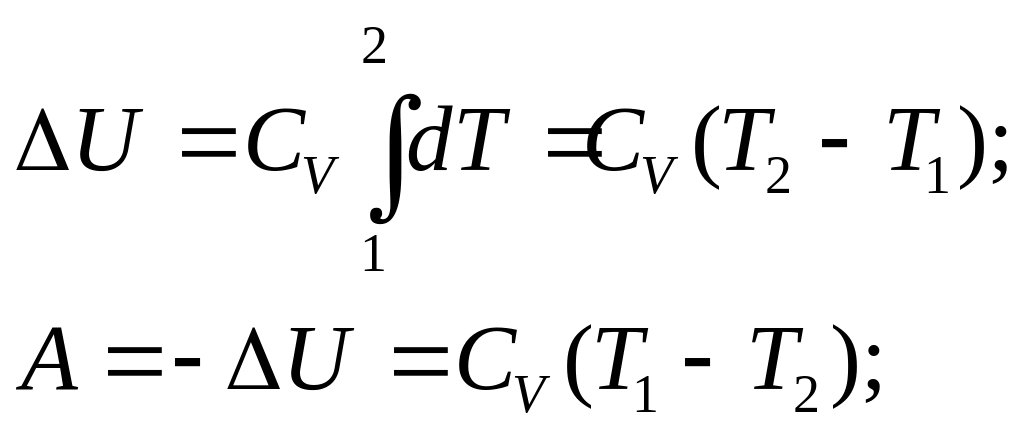
Вопрос №4.
Второе начало термодинамики.
1ое начало: смысл закона сохранения энергии в тепловых процессах на осн практич измерений, но не позволяет определить направление протекания процесса.
2ое начало: определяет направление протекания процесса.
Клазиус: тепло не может передаваться само по себе от менее нагретых тел к более нагретым(отражает направление процесса)
Планк( Физ смысл): невозможен такой процесс, единым рез-том кот было бы превращение теплоты в работу.
Невозможно по Планку:

Q=ΔU+A
Q=A(ΔU=0, при изотерм процессе)
![]()
Кельвин: невозможно построить такую тепловую машину, кот-я превращала бы в работу тепло наиболее холодного из имеющихся в системе тел.
Цикл Карно и его кпд.
Цикл – после процессов, происходящих в газе все пар-ры должны придти в первонач сост-е.
Рез-том цикла является передача тепла. Каждый тепловой двигатель работает по своему циклу
Цикл Карно состоит из 2х адиабат 2х изотерм(идеальный цикл)

1→2 (T1=const) Q1>0; A1>0
2→3 (адиабата) ΔT<0; T2; A|>0
3→4 (изотермич T2=const) Q2<0; A2<0
4→1 (адиабата) ΔT>0 станет Т1; A||<0
В результате: A|+A||=0, поэтому
определяется только изотермами
A=A1-A2 A=Q1-Q2
![]()
Для идеальной тепловой машины необходимо наличие теплоотдатчика, раб в-ва, и теплоприемника (работает по циклу Карно)
Рисуй Рис1
T1>T2
![]() Чем
T1>T2,
тем больше η, на η влияет не конструкция,
а цикл по кот она работает.
Чем
T1>T2,
тем больше η, на η влияет не конструкция,
а цикл по кот она работает.
Технич циклы не являются обратимыми
Обратимые и необратимые циклы, их кпд.
Обратимый может протекать в прямом и обратном направлении без изменений во внеш телах, но и не взаимод с внешним миром.
Механизм – без трения и не сопровождаются неупругими ударами.
Если удар абсолютно упругий, будет выполняться закон сохранения энергии и процесс будет обратимым.
Цикл: Q1-Q2=A – только в рез-те взаимодействия с окружающими телами. Процесс превращения мех работы в теплоту(без вмешательства) но наоборот с вмешаьтельством, т.е. в целом цикл необратимый, есть участки с необрат цик-ми, но в сложном цикле можно выделить обратимые циклы, входящие в этот слож цикл.
Пример необр цикла – расширение газа в пустоту.→молекулы никогда сами не собирутся в объеме
Сопоставление кпд обратимого и необрат процессов
Рассм. совмещ работу 2х тепловых машин. Одна работает по обратимому циклу, а другая по необратимому
Если Q1=Q1| и η=η1 , то каждое передает одинаковое кол-во теплоты
Q2=Q2| →A1=A1|
Пустим теперь одну машину в обратном направлении в
Q1=Q1| (забирает необрат, отдает обрат) η|>η
A=Q1-Q2 A|>A Q2|<Q2 необратимая машина отдает кол-во теплоты меньше, т.е холодильник получает тепла меньше чем отдает →A|-A>0, обрат машина сов-ет работу>0, все забираемое тепло превращ в работу, это невозможно → η|>η неверно
Вывод: кпднеобрат машины не м.б больше кпд обрат машины.
Можно сделать предположение, что η>η|
Приведенное кол-во теплоты, неравенство Клазиуса
Теп. Машина – система тел, сов необ и обрат циклы, причем ηобрат>ηнеобрат
η=Q1-Q2/Q2 (1) это для любой машины
η=T1-T2/T2 (2) для цикла Карно
Q1-Q2/Q2<= T1-T2/T2 (3)
![]()
![]()
Q1 – тепло, кот раб в-во получает от нагревателя при темп-ре T1
Q2 – тепло, кот раб в-во отдает теплоприемнику при Т2
Если процесс необратимый, то = 0, если наоборот то меньше 0
![]() алгебраич
сумма, т.е должны учесть знак тепла.
Q/T –
приведенное кол-во теплоты.
алгебраич
сумма, т.е должны учесть знак тепла.
Q/T –
приведенное кол-во теплоты.
Если тело вступает в теплообмен с 2-мя телами, наход при постоян температуре, то алгебраич сумма привед кол-ва теплоты будет либо равна 0 либо меньше0(из(6))
![]() интеграл
Клазиуса
интеграл
Клазиуса
(6),(7),(8) – неравенства Клазиуса
Технические циклы, тепловые машины
Вопрос №5.
Понятие энтропии, термодинамическое и стат опр-е энтропии.
 Рассм замкн
цикл, каждая ветвь кот-й обратима, след-но
весь цикл обратим, т.е происходит без
внеш воздействия.
Рассм замкн
цикл, каждая ветвь кот-й обратима, след-но
весь цикл обратим, т.е происходит без
внеш воздействия.
Применим нер-во Клазиуса:
![]()
Разобъем интеграл
![]()
![]()
![]()
Интеграл не зависит от формы пути, след-но подинтег выр-ние есть ф-ия состояния, она наз-ся энтропией
![]() Физ
смысл(мера неработоспособности): Q/T
– получает раб в-во от нагревателя при
данной темп-ре, если темп-ра нагр увел,
то кпд увел.
Физ
смысл(мера неработоспособности): Q/T
– получает раб в-во от нагревателя при
данной темп-ре, если темп-ра нагр увел,
то кпд увел.
Q/T=ΔS, чем выше темп-ра нагр-ля, тем ниже изм-е энтропии
В тепл машине: чем ниже ΔS раб в-ва, тем выше кпд и чем выше ΔS, тем ниже кпд, ниже работоспособность, т.е. энтропия асоц с работоспособностью.
Стат смысл: чем больше энтропия, тем больше вер-ть события
Т.о для обратимого процесса изм-е энтропии равно 0
(ΔS=0(*)), т.е если ΔS=0, то цикл обратимый.
Энтропия системы, сов-щей необратимый цикл, возрастает: ΔS>0 (**)
Выр-ния (*) и (**) относятся только к замкнутым системам, если же система обменивается теплотой с внеш средой, то ее энтропия м вести себя любым образом.
Рассм замкнут процесс: одна ветвь nb1 обратима, а другая 1ап необратима, т.е в целом цикл необратим.
![]() ;
;
![]()
![]()
![]() В необр процессе
энтропия возрастает, след-но ΔS>=0,
т.е в необр процессе она возр
В необр процессе
энтропия возрастает, след-но ΔS>=0,
т.е в необр процессе она возр
1-е н.т/д: dQ=dU+dA=dU+pdV (1)
2-е н.т/д: dS=dQ/T (2)
Подставим 1-е во 2-е: dS=(dU/T)+(pdV/T) (3)
dU=CVdT pV=RT pdV=RdT (при p=const)
dSp=(CVdT/T)+(RdT/T)
В общем случае: выразим из М-К p: p=RT/V
![]()
Проинтегрируем:
S=CVlnT+RlnV+S0
или
![]() осн ур-е тер-дин-ки
осн ур-е тер-дин-ки
V=const ΔSV=CVlnT2/T1
T=const ΔST=RlnV2/V1
P=const ΔSP=CVln(T2/T1)+RlnT2/T1=CPlnT2/T1
Адиаб. dQ=0; ΔS=dQ/T>=0 обр процесс т.е S=const
Все урав-ния м переписать исп-я энтропию или внут энергию, т.к это ф-ции состояния
(1) V=const dS=CVlnT2/T1; S=CVlnT+lnS0
![]()
![]()
2.Цикл Карно
2 адиаб =
адиаб =
2 изотер ||
3. T1>T2
![]()
![]()
![]()
I: ΔS1=-Q/T1(выдел-т тепло)
II: ΔS2=Q/T2(погл тепло)
ΔS= ΔS1+ ΔS2=(-Q/T1)+(Q/T2)=Q(1/T2-1/T1)=Q(T1-T2./T1T2)>0,
Но T1>T2 след-но ΔS>0.
Более глубокий смысл энтропии раскрывается в стат физике: Энтропия связывается с т/д вероятностью сост системы.
Т/д вероятность – число способов, кот-ми м/б реализовано данное сост-е макроскоп системы, или число микросостояний осущ данное макросостояние
Вопрос №7
Распределение молекул в силовом поле. Барометрическая формула. Распределение Больцмана в случае дискретных значений энергии
Барометрическая ф-ла: Цель: как измен-ся атм давление при подъеме над Ур-м Земли.
P=ρgh ρ- не один в воздухе, g- тоже разное, след-но по этой формуле давление сосчитать не возможно.
Предположим, что Т не изм-ся, впределах dh не изме-ся пл-ть
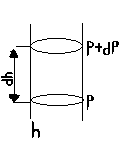
p-(p+dp)=ρgdh ; -dp=ρgdh;
PV=m/μRT следов-но ρ=pμ/RT
-dp=(pμg/RT)dh → dp/p=-(μg/RT)dh →
Lnp=-(μgh/RT)+lnC
Если h=0 тогда lnC=lnp0
![]()
Это значит, что изм-ние давления зависит от массы мол-лы и от температуры, но t=const, след-но и от m. На это влиляет тепл. Дв-е и гравитация
Расп-е Больцмана:
![]() (n0-на
пов-ти Земли)
(n0-на
пов-ти Земли)
![]() - Ф-ия распр-я
Больцмана(1)
- Ф-ия распр-я
Больцмана(1)
Факторы: Гравитация – притянуть все мол-лы на пов-ть Земли
Тепловое движ-е
– разбросать все мол-лы подальше от З,
т.е сущ противодействие![]()
Распределение Больцмана справедливо для любого поля
n1 – концен-я ч-ц в тех уч-ках поля, где EP1
n2 – где EP2; n0 – где EP0
![]()
dn – число частиц, скорости кот в интервале dυ
![]()
Если ч-цы еще и находятся в пот поле:
![]() Это
расп-е, если энергия частиц изм-ся
непрерывно (где W-пол.эн)
Это
расп-е, если энергия частиц изм-ся
непрерывно (где W-пол.эн)
![]()
![]()
Если энергия изменяется дискретно, например, энергия атома, то данное расп-е не подходит, поэтому
![]()
![]()
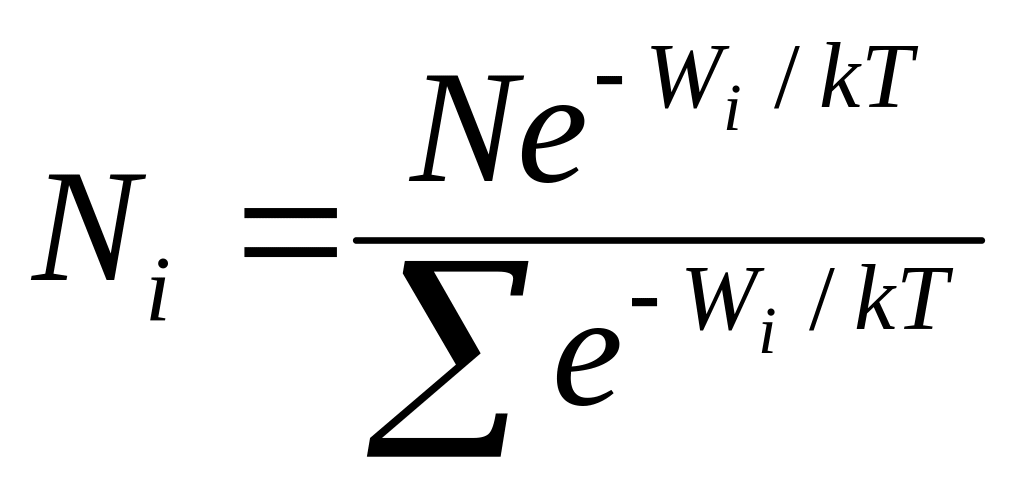 Силовое поле –
пр-во, окружающее эл заряды. Больцман
доказал, что распределение (1) справедливо
не только в случае пот поля сил земного
тяготения, но и в любом пот поле сил для
совокупности любых одинаковых частиц,
нах-ся в состоянии хаотич теплового
дв-я
Силовое поле –
пр-во, окружающее эл заряды. Больцман
доказал, что распределение (1) справедливо
не только в случае пот поля сил земного
тяготения, но и в любом пот поле сил для
совокупности любых одинаковых частиц,
нах-ся в состоянии хаотич теплового
дв-я
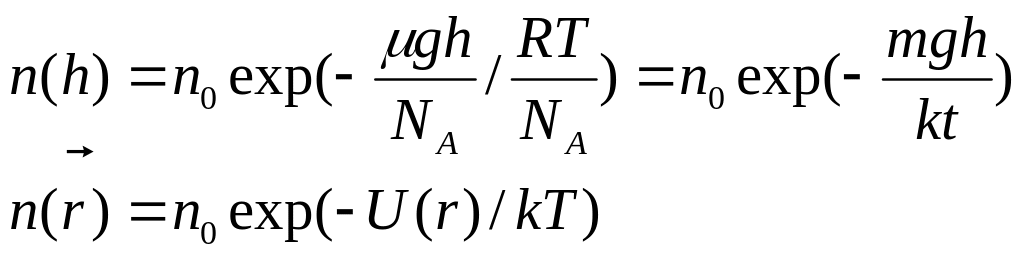 -расп-е
в силовом поле
-расп-е
в силовом поле
Вопрос №8
Плнятие о степенях свободы мол-л и теорема о равномерном расп-ии энергии по степеням свободы. Классич теория теплоемкости газов итв тел. Закон Дюлонга-Пти. Понятие о «замороженных» ст. свободы. Адиаб процесс. Ур-ие адиабаты.
Число степеней свободы – число независимых переменных(коор-т), полностью опред-х полож-е сис-мы в пр-ве.
В ряде задач мол-лу 1-атомного газа рассм как мат точку, кот приписывают 3 степени свободы пост. дв-ия.
Вкласс мех-ке мол-ла 2-атомного газа в 1-м приближении рассм как совок-ть 2х мат точек, жестко связанных недеформ связью. Эта сис-ма кроме 3-х ст свободы пост движения имеет еще 2 ст своб. вращ движ-я.
Т.о 2х-атомный газ обл-т 5-ю степенями свободы (i=5).
Трехатомная и многоатомная нелин мол-лы 6 ст свободы: 3-пост и 3-вращ. Реально жест связи между мол-ми не сущ-ет поэтому необходимо учитывать степени свободы колеб движ-я.
Независимо от общего числа ст св молекул 3 степени всегда пост
Ни одна из пост ст свободы не имеет преимущества перед другой, поэтому на каждую из них приходитсяв среднем одинаковая энергия, равная 1/3 зн <E0> в формуле <E0>=(3/2)kT – средняя кин энергия пост движ-я одной мол-лы <E1>=<E0>/3=(1/2)kT
В класс стат физике выводится з Больцмана о равномерном распред-и энергии по степеням свободы мол-л: для стат сис-мы, нах-ся в сост-и т/д равновесия, на каж-й пост и вращ ст свободы приходится в ср.кин энергия = kT/2, а на каж колеб, энергия=kT
Колеб степень обладает вдвое большей энергией потому, что на нее прих-ся не только кин энергия но и пот энергия причем их значения одинаковы.
Т.о ср энергия мол-лы: <E>=(i/2)kT (i- сумма числа пост, вращ, и удвоен числа колеб степ свободы)
Т.к в идеальном газе взаимная пот энергия = 0, то внут энергия NA молекул:Um=(i/2)kTNA=(i/2)RT (1моль); U=(m/μ)(i/2)RT=ν(i/2)RT
Теплоемкость – физ вел-на, хар-ая какое кол-во теплоты необх чтобы нагреть тело на 1 град. СТЕЛА=Дж/град
Уд теплоемкость – кол-во теплоты необх для нагревания ед массы на 1 кельвин: СУД=Дж/кгК
Мол теплоемкость: СМОЛЬ=Дж/мольК
СУД=СМОЛЬ/μ=СТЕЛА/m cm – теплоемкость тела
Q=cm(t2-t1)=CТЕЛА(t2-t1) dQ=CdT, след-но С=dQ/dT
Для газа небезразлично то условие при кот происходит нагревание. Различают нагревание при P=const и V=const и теплоемкости будут различны.
CP,CV – молярные теплоемкости
V=const. Все тепло идет только на нагревание, т.е изменение внут энергии. ΔQV=ΔU U=(i/2)RT, след-но ΔU=(i/2)RΔT
ΔQV=(i/2)RΔT; CV=ΔQV/ΔT=(i/2)R
P=const.
QP=ΔU+ΔAP тепло идет на нагревание и совершение работы
ΔAP=RΔT ΔQP=(i/2)RΔT+RΔT=(i/2R+R) ΔT=((i+2)/2)RΔT
CP=((i+2)/2)R
CP/CV=(i+2)/i=γ – показатель адиабаты
-)С не зависит от темп-ры, для каждого газа постоянна
При абсолютной Т, С→0 Уменьшение С при уменТ ведет к уменьш числа степеней свободы (т.е замороженные степени свободы)
-)Закон Дюлонга и Пти: атом теплоемкость простых хим веществ постоянна и равна 3R и не зависит от температуры. Выполняется при дост выс. Т, характерно для каждого в-ва.
Каждая составляющая крист решетку ч-ца имеет 3 колеб степени свободы, на каждую приходится энергия кТ
Um=3NAkT=3RT; CV=dUm/dT=3R=25Дж/мольК
Для хим соединений CV=3nR=25n Дж/мольК
Адиабатический процесс – процесс, кот происходит без обмена теплом с окр средой
На практике: изотермич процесс нужно проводить очень медленно
Адиабат процесс протекает очень быстро и все процессы, кот в природе протекают быстро приближенны к адиабатич.
dQ=dU+dA (1)
dQ=0; U=CVT; dU=CVdT; dA=pdV
0=CVdT+pdV (2) pV=RT, след-но p=RT/V
0=CVdT+RTdV/V
![]()
lnT+(R/CV)lnV=const lnT+lnVR / Cv=const
ln(TVR / Cv)=const TVR / Cv=const|
R/Cv=(Cp-Cv)/Cv=γ-1 след-но TVγ-1=const
T1/T2=(V2/V1)γ-1
T=pV/R pVVγ-1=const| pVγ=const – уравнение Пуассона – описывает процесс
P1/γV=const;
V=RT/P;
![]()
![]()
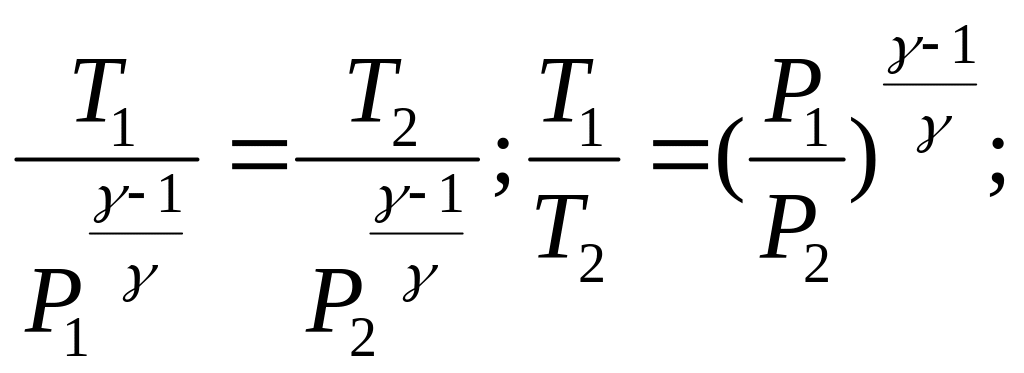

Изотермический процесс: PV = const;
pdV+VdP=0;
dP/dV=-P/V;
PVγ=const – адиаб.
VγdP+γPVγ-1dV=0
Vdp+γPdV=0
![]() -
Ур-е адиабаты.
-
Ур-е адиабаты.
У адиабаты угол наклона больше.
Вопрос №9.
Хар-р теплового движ-я мол-л и св-ва в-ва в разл. агр-х сот-х.
Основной моделью МКТ явл-ся совок-ть диж-ся и взаим-х м/у собой мол-л вещ-ва. Взаимное распол-е, хар-р движ-я и взаим-я мол-л, сущ-о зависит от внеш-х усл-й (Т, Р), характ-т его агрег-е сост-е.
Различают 4 АС: Т,Ж,Г,Плазменное.
Фаз. Переход – переход сист-ы из одного АС в другое. Реализация того или иного АС зав-т от сост-я кин. и пот энергии мол-л.
Тв.тело – вещво нах-ся в тв. сост-ии, если ср. пот. энергия прит-я мол-л >> их ср. кин-й энергии.
Каждая мол-а занимает определ-й Vпрос-ва, притягивая сосед. молекулы и одновр. отталк-я их, не давая занять своё место.
Ч-цы кол-ся около нек-х ср-х положений равновесия – узлы кр.р.
Тв.тела сохраняют форму объём.
Жидкость : при нагревании ↑ кин. эн-я, ↑ амплитуда кол-я, ↓ эн-я связи мол-л →нарушение дального порядка. Фаз переход: Т→Ж.
Частицы кол-ся в большой области, пол-я равн-я подвижны.
Ср. кин. энергия мол-л соизмерима со ср. пот. энер. их притяжения.
Ближний порядок Ж течёт и принимает форму сосуда. Текучасть объясняется тем, что мол-лы дв-ся в напр-ии дейст-я внеш-й силы.
Газ – ср.кин.энергия > ср.пот.энергии.
М. неограниченно расиряться в пространстве. Сжимаемость объясн-ся межмолек-м пространством.
Мол-лы движ-ся по прямолинейным траект-м, столкн-я измен-т напр.
Плазма: ↑T, ↑ кин.эн. →деф. э-х оболочек и выбивание е-в из атомов.
Состав газа – мол-лы и заряж-е частицы, заряд не измен-ся, т.о. это электронейтральная совокупность нейтральных и заряженных час-ц.
Фаза.
Физ. однородное тело, занимающее опред-й объём. В пределах одного АС вещ-о м. нах-ся в неск-х фазах, отличающ-ся по своим свой-м, составу и строению. (лёд м. нах-ся в 5 фазах). Переход в-ва из одной фазы в другую – фаз-й переход- изм-е св-в вещ-ва.
Фаз-й переход I рода(плавл.,кристалл-я) сопр-ся поглощением или выделением теплоты, хар-ся постоянством t, изм-ми S и V/
Фаз-й переход II рода – не связаны с поглощением или выделением теплоты и измен-м V. Хар-ся пост-м V и S, но скачкообр. изменением теплоёмкости.
