
Лабораторные работы по термодинамике
.pdfПредисловие
Издание содержит методические указания по выполнению лабораторных работ по физике для студентов 1-го курса 1-го семестра. Описание каждой работы состоит из следующих частей: название работы; цель работы; перечень приборов и принадлежностей; исследуемые закономерности; указания по выполнению наблюдений; задание по обработке результатов; контрольные вопросы.
Задание по подготовке к работе
При подготовке к работе учащийся должен:
1)изучить описание работы и продумать ответы на контрольные вопросы;
2)подготовить вводную часть отчета: название работы, цель работы, перечень приборов и принадлежностей, конспект части методических указаний «Исследуемые закономерности»;
3)подготовить протокол наблюдений.
Протокол наблюдений содержит название работы; таблицы, которые заполняются во время проведения работы; данные о студенте (ф. и. о., номер группы). Форму таблиц студент разрабатывает самостоятельно.
Протокол наблюдений и отчет по лабораторной работе аккуратно оформляются на одной стороне бумаги формата А4.
Содержание отчета
Отчет должен содержать:
1)титульный лист;
2)вводную часть: название работы, цель работы, приборы и принадлежности, конспект части методических указаний «Исследуемые закономерности»;
3)расчетную часть в соответствии с «Заданием по обработке результатов»;
4)выводы по работе.
Расчеты должны быть подробными, их нужно снабдить необходимыми комментариями. Результаты расчетов, если удобно, сводятся в таблицу. Рисунки и графики выполняются карандашом на миллиметровой бумаге.
3
Лабораторная работа 1
Определение скорости распространения звука в воздухе
Цель работы: определение скорости распространения звуковых колебаний в воздухе при данной температуре методом стоячих волн.
Приборы и принадлежности: установка акустического резонанса, электронный осциллограф, звуковой генератор.
Исследуемые закономерности
Звуковые колебания в газе представляют собой периодическое чередование сжатий и разрежений, распространяющихся со скоростью, зависящей от свойств воздуха. Газы, в отличие от твёрдых тел, не обладают деформацией сдвига, поэтому в них возникают только продольные волны. Продольные волны обусловлены объёмной деформацией.
Если сжатие происходит быстро, то выделяющееся при этом тепло не успевает распространиться в соседние слои. Сжатие без отвода тепла называется адиабатическим; в этом случае скорость распространения звука рассчитывают по формуле
u = (γ p / ρ)1/2, |
(1.1) |
где γ = Cp / CV – отношение теплоёмкостей газа при изобарическом и изохорическом процессах (для воздуха γ = 1,4); p и ρ – соответственно, средние значения давления и плотности во всем объеме.
Соотношение (1.1) может быть преобразовано с учетом уравнения со-
стояния идеального газа (pV = (m/µ)RT): |
|
u = (γRT / µ)1/2, |
(1.2) |
где R – газовая постоянная; Т – температура; µ – молярная масса газа (для воздуха µ = 29 10–3 кг / моль).
Удобным методом измерения скорости звуковых волн является метод, основанный на измерении длины волны λ стоячих звуковых волн. Если из-
мерена λ и известна частота ν возбуждаемых звуковых волн, то |
|
u = λ ν. |
(1.3) |
Стоячие звуковые волны возникают при интерференции падающей и отраженной волн. Точки, в которых амплитуда колебаний максимальна, называются пучностями стоячей волны. Точки, в которых амплитуда колебаний равна нулю, называются узлами стоячей волны.
Явление резонанса наблюдается в том случае, если длина резонатора Ln,
4
в котором устанавливается стоячая волна, равна целому числу полуволн:
Ln = nλ / 2, n = 1, 2, 3,... |
(1.4) |
Явление резонанса резко выражено в том случае, если затухание мало. В данном случае затухание обусловлено неполным отражением волн и потерями на излучение из резонатора в окружающую среду, оно невелико, и можно считать, что период колебаний T 2π / ω0. Характеристикой убыли энергии при затухании служит добротность системы
Q = 2πW(t) / (W(t) – W(t + T)).
Знаменатель представляет убыль энергии за период, отсчитываемый от момента времени t. Добротность можно рассчитать также по следующей формуле: Q = πNе, где Nе − число колебаний за время, в течение которого амплитуда колебаний уменьшается в e раз.
Небольшая расстройка (т. е. отклонение) частоты относительно резонансной позволяет наблюдать изменение амплитуды колебаний в соответствии с амплитудно-частотной характеристикой резонатора:
Aν = A0 / (1 + ((ν–ν0) / ∆ν0)2)1/2,
где A0 и ν0 – амплитуда и частота при резонансе; ∆ν0 – ширина резонансной кривой, которая определяется как разность частот, при которых амплитуда
Aν = A0 /21/2.
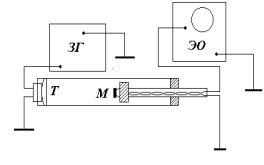
Метод измерений. Работа выполняется на установке, схема которой приведена на рис. 1.1. На одном конце кварцевой трубы находится телефон T, являющийся источником звука. Телефон соединен со звуковым генерато-
ром ЗГ. Колебания мембраны телефона |
|
|
|
|
|
|
|
|
|
создают периодические сгущения и раз- |
|
|
|
|
|
|
|
|
|
режения в прилегающем к ней слое воз- |
|
|
|
|
|
|
|
|
|
|
ЗГ |
ЭО |
|||||||
духа, возбуждая акустическую волну. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Внутри трубы перемещается пор- |
Т |
|
|
М |
|
|
|||
|
|
|
|
||||||
|
|
|
|||||||
шень с вмонтированным в него приемником – микрофоном М. Микрофон принимает звуковые колебания, преобразует их
в электрические и передает на вход Y электронного осциллографа ЭО. На экране осциллографа возникает синусоидальный сигнал, амплитуда которого различна в зависимости от частоты колебаний и длины резонатора.
При выполнении условия (1.4) наступает резонанс, при котором амплитуда наблюдаемых колебаний максимальна. Настройка на резонанс может быть осуществлена либо изменением длины воздушного столба в трубе (пе-
5
ремещением поршня), либо изменением частоты колебаний генератора. В работе используется первый способ.
Указания к проведению наблюдений
1.Включить осциллограф, и после появления на экране сигнала установить удобный для наблюдения размер изображения.
2.Поршень с микрофоном придвинуть как можно ближе к телефону. Медленно удаляя микрофон от телефона, найти положение, при котором на экране осциллографа наблюдается первый максимум амплитуды колебаний. По измерительной линейке определить длину L1 резонатора (расстояние от телефона до микрофона). Продолжая перемещать поршень, найти длины L2 и L3 резонатора при двух последующих резонансах.
3.Перемещая микрофон в обратном направлении, вновь зафиксировать длины резонаторов L1; L2 и L3. Указанную процедуру повторить пять раз. Полученные данные, т. е. три серии по 10 измерений, записать в таблицу.
4.Не меняя частоту генератора, установить микрофон в положение L2. Затем плавным изменением частоты уточнить положение резонанса, добиваясь максимального значения амплитуды сигнала на экране осциллографа. За-
писать значение резонансной частоты ν0 и амплитуды колебаний А0 (в делениях сетки экрана осциллографа). Изменяя частоту генератора относительно ν0 в сторону увеличения, а затем уменьшения частоты, записать соответствующие значения амплитуд колебаний Аν.
5. Записать в протокол определенную по термометру температуру воздуха в лаборатории.
Задание на обработку результатов
1.Вычислить для каждого из трех резонансов (n = 1, 2, 3) длину волны и скорость звука.
2.По данным выборки из 30 значений вычислить скорость звука. Результат представить в стандартной форме u = <u> ± ∆u. Коэффициент Стьюдента для N = 30 (при доверительной вероятности P = 95%) равен 2,2, коэффи-
циент uР,N = 0,26.
3.Вычислить скорость звука по формуле (1.2) и сравнить с экспериментально полученным значением.
4.Построить экспериментально полученную резонансную кривую Аν = f (ν). Определить ее ширину ∆ν0 на уровне А0 / 21/2.
6
5. Рассчитать добротность резонатора по формуле Q = ν0 / ∆ν0.
Контрольные вопросы
1.К какому типу волн − продольных или поперечных − относятся акустические волны, распространяющиеся в воздухе?
2.Какие волны называются стоячими? Как образуются стоячие волны?
3.Свободными или вынужденными являются колебания, возникающие в резонаторе при условиях, заданных в работе?
4.В чем заключается явление резонанса?
5.При каких условиях, заданных в работе, наблюдается явление резонанса? Как оно фиксируется?
6.Какие колебания называются затухающими? Назовите физические величины, характеризующие затухание, и определите их физический смысл.
7.Изобразите качественно график зависимости скорости звука от температуры.
Лабораторная работа 2
Изучение термодинамического цикла при сжатии и расширении воздуха
Цель работы: исследование политропно-изохорно-изотермического цикла, измерение показателя политропы; построение цикла.
Приборы и принадлежности: баллон с воздухом, манометр, микрокомпрессор, лабораторные термометр и барометр.
Исследуемые закономерности
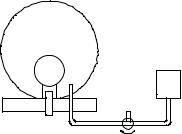
Метод измерений. Используемая в работе установка изображена на
рис. 2.1. Баллон А объёмом V1 может сооб- |
|
|
щаться либо с насосом H, либо с атмосферой. |
А |
|
Внутрь баллона помещён манометр М, изме- |
|
|
|
|
|
ряющий избыточное давление. Одно деление |
M |
H |
шкалы равно 4 мм вод. ст., что составляет |
|
|
|
K |
|
40 Па. Рабочим газом является воздух. В ис- |
|
|
ходном состоянии параметры состояния воз- |
Рис. 2.1 |
|
духа следующие: давление p2 и температура |
|
|
|
|
T1. Диаграмма исследуемого цикла в координатах давления p и объёма V показана на рис. 2.2.
7
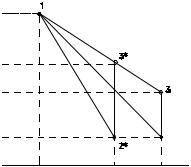
В исходном состоянии воздух имеет давление p2 и температуру T1. Насосом в баллон накачивают воздух до давления p1 = p2 + ∆p1 (состояние 1 (p1; V1)). При сжатии воздух нагревается, поэтому после закрытия крана необходимо выждать некоторое время, пока температура воздуха в баллоне не сравняется с температурой окружающей среды.
Затем воздух выпускают через кран К в атмосферу в течение нескольких секунд. Когда стрелка манометра приблизится к нулю, кран закрывают. В этот момент давление воздуха баллоне становится p2 (состояние 2 (p2; V2). Изменение параметров состояния воздуха в процессе расширения отражает линия 1−2, которая является политропой.
После закрытия крана охлаждённый при расширении воздух изохори-
чески нагревается до температуры окружающей среды в результате теплооб- |
||||||||||||||||
р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мена. Изменение параметров состояния воз- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
духа отражает линия 2−3, которая является |
|
р1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изохорой. Температура воздуха в баллоне |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
3 |
|
|
|
|
||||||
р3 |
|
|
|
|
|
|
|
|
|
|
становится равной температуре в точке 1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(T3 = T1), следовательно, точки 1 и 3 лежат на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||
р3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одной изотерме. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
р2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
После выравнивания температур давле- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
|
|
2 |
ние в баллоне изменится на ∆p3 и станет |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
V1 |
|
V2 |
V2 V |
p3 = p2 + ∆p3 (состояние 3 (p3; V2)). Таким об- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разом, ∆p1 и ∆p3 − это изменения давления на |
Рис. 2.2 |
участках 1−2 и 2−3. Участки 1−2 и 1−3 на |
|
диаграмме можно аппроксимировать прямыми, так как изменения параметров p, V, T в данной работе малы и много меньше абсолютных значений соответствующих величин.
В работе изучается политропно-изохорно-изотермический (nVT) цикл. Процесс расширения газа на участке 1−2 можно также рассмотреть как адиабатический. Такой цикл назван адиабатно-изохорно-изотермическим (SVT) циклом.
Определение показателя политропы. Первое начало термодинамики формулируется следующим образом: сообщённое системе количество теплоты δQ расходуется на увеличение внутренней энергии ∆U системы и совершение системой работы δА:
δQ = ∆U + δA = CV dT + p dV,
где CV – теплоёмкость газа при изохорном процессе.
8
nVT-цикл. Процесс расширения воздуха на участке 1−2 (рис. 2.1) рассматривается как политропный, при котором теплоёмкость газа С остаётся постоянной. Тогда первое начало термодинамики имеет вид
CV′ dT + p dV = 0,
где CV′ = CV − C. Из этого соотношения с помощью уравнения состояния идеального газа можно получить уравнение политропного процесса TV n−1 = const или рV n = const, где n – показатель политропы,
n = (Cp − C) / (CV − C).
SVT-цикл. Полагаем, что процесс адиабатного расширения воздуха на участке 1−2* (рис. 2.1) обратимый. Адиабатный процесс происходит без теплообмена с окружающей средой, δQ = 0, поэтому
∆U + δA = СV dT + рdV = 0.
Из этого соотношения с помощью уравнения состояния идеального газа можно получить уравнение адиабатного процесса T V γ−1 = const или р V γ = const, где γ − показатель адиабаты. Его значение равно отношению теплоёмкостей газа при изобарном и изохорном процессах, γ = Cp / CV. Для воздуха γ = 1,4.
Показатель политропы n может быть определён экспериментально. Выразим n через экспериментально измеренные величины, для чего продифференцируем уравнения политропы (рVn = const) и изотермы (рV = const): рnV n−1 dV + V n dр = 0 − для политропы и рdV + V dр = 0 − для изотермы. Преобразуем соотношения к виду
|
|
dp |
|
|
|
|
np |
|
|
|
dp |
|
|
|
np |
|
|
||||||||
|
|
|
|
|
= − |
|
|
|
|
; |
|
|
|
|
|
|
= − |
|
|
|
. |
||||
|
dV |
|
V |
|
|
|
|
|
|
|
V |
||||||||||||||
|
|
n |
|
|
|
dV |
|
n |
|
|
|
|
|||||||||||||
При относительно малых изменениях ∆p и ∆V тангенс угла наклона по- |
|||||||||||||||||||||||||
литропы 1−2 и изотермы 1−3 (см. рис. 2.1) рассчитывается по формулам |
|||||||||||||||||||||||||
|
|
dp |
|
|
|
∆ p |
|
|
|
|
dp |
|
|
|
|
|
|
p |
|
|
|||||
|
|
|
|
|
= − |
|
|
1 |
; |
|
|
|
|
|
|
= − |
|
|
|
, |
|||||
|
dV |
n |
|
|
∆ V |
|
|
dV |
|
|
T |
|
|
V |
|
|
|||||||||
где ∆V = V2 − V1. Из отношения приведенных уравнений получаем формулу |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
∆ p1 |
|
|
|
. |
|
|
|
|
|
(2.1) |
|||||
|
|
|
|
|
|
n = |
∆ p1 |
− ∆ p 3 |
|
|
|
|
|
|
|
|
|
||||||||
Зная n, можно определить мольную теплоемкость газа в политропном процессе (мольные величины обозначаем соответствующими строчными буквами)
с = сV − R / (n − 1), |
(2.2) |
9

где R – универсальная газовая постоянная, равная 8,31 Дж/(K моль); сV − мольная теплоемкость воздуха при постоянном объеме. При нормальных условиях сV определяется числом степеней свободы (i) молекул (считать воздух двухатомным газом):
сV = (i / 2) R. |
(2.3) |
На участке 1−2 воздух охлаждается, поэтому величина с имеет знак «минус».
Расчёт холодильного коэфициента. Холодильный коэффициент ε определяется как отношение теплоты, отнятой от охлаждаемого газа, к затраченной в цикле работе. Для SVT-цикла ε равен
ε (SVT) = |
Q 2 3 |
= |
A12 |
. |
|||
A |
A13 − A12 |
||||||
|
|
|
|||||
Для nVT-цикла ε равен |
|
|
|
|
|||
ε (nVT) = |
|
|
A12 |
|
|||
|
|
. |
|
||||
A13 |
− A12 |
|
|||||
Перепишем выражения для ε, используя экспериментально измеренные величины давлений, для чего значения работы А12 и А12* определим графическим способом. В рV-координатах (рис. 2.2) они равны площадям трапеций,
основания которых р1 и p2 = р2*, а высоты − (V2 −V1) и (V2* − V1) соответственно. После преобразований получаем:
ε (nVT) = |
2 p 2 |
и ε (SVT) = |
2 p 2 |
. |
|
|
∆p3 |
|
∆p |
3* |
|
|
|
|
|
|
|
В нашем опыте ∆p3 больше, чем ∆p3, поэтому отношение холодильных коэффициентов ε (nVT)/ ε (SVT) больше единицы.
Расчет изменения энтропии. Функция состояния, дифференциалом которой является δQ / T, называется энтропией,
dS = δTQ .
Отметим, что данное выражение справедливо лишь для обратимых процессов и дает определение разности энтропии, но не ее абсолютное значение.
Выразим изменение энтропии ∆S через экспериментально измеренные величины давлений сначала для nVT-цикла. При политропном процессе (на участке 1−2)
∆S12 |
|
|
|
T |
|
p |
|
|
|
|
n −1 |
|
p |
2 |
. |
= ν |
с |
ln |
2 |
− R ln |
|
2 |
|
= ν c |
|
|
− R ln |
|
|||
T |
p |
|
n |
|
|
||||||||||
|
|
p |
|
|
|
|
p |
|
p |
||||||
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
1 |
|
10
Логарифм отношения заменяем приращениями соответствующих величин и учитываем, что для воздуха сV / R = 3,5, тогда
∆S12 |
|
− 3,5 |
n − 1 |
|
∆p |
= νR 1 |
n |
|
1 . |
||
|
|
|
|
p2 |
При изохорном процессе (на участке 2−3) изменение энтропии равно:
|
|
|
|
|
|
n −1 |
|
|
|
∆S23 |
= ν c ln T3 |
= ν c ln |
|
p1 |
n |
= ν c |
n − 1 ∆p1 |
= 2, 5ν R n − 1 ∆p1 . |
|
|
|
|
|||||||
|
V |
T2 |
V |
p2 |
V |
n p2 |
|||
|
|
|
|
|
|
n p2 |
|||
При изотермическом процессе (на участке 3−1)
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
V1 |
|
V1 |
|
p1 |
|
− |
|
|
1 |
|
∆p1 . |
∆S |
|
= |
|
|
n |
|
|
||||||||
31 |
νR ln |
= νR ln |
|
|
|
|
= − |
νR |
|||||||
|
|
V3 |
V2 |
= νR ln |
p 2 |
|
|
|
n |
p 2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Для SVT-цикла изменение энтропии при адиабатном процессе (на участке 1−2*) равно нулю.
Изменения энтропии при изохорном и изотермическом процессах равны по величине, но различаются знаком:
∆S3*1 = νR 1 ∆p1 .
γ p2
При расчетах учесть, что сумма изменений энтропии за цикл равна ну-
лю.
Указания к проведению наблюдений
1.Насосом накачать в баллон воздух до давления 0,9 − предельного по шкале манометра и закрыть кран. После того как воздух в баллоне охладится до комнатной температуры, записать установившееся избыточное давление ∆p1.
2.Открыть кран на атмосферу и, как только избыточное давление в баллоне упадёт до нуля, закрыть кран. Когда воздух в баллоне нагреется до комнатной температуры (перестанет уменьшаться давление в баллоне), записать значение установившегося избыточного давления ∆p3.
3.Действия, описанные в пп.1, 2, выполнить 10 раз.
4.Барометром и термометром, имеющимися в лаборатории, измерить атмосферное давление p2 и температуру воздуха T1. Объём баллона V1 указан на панели установки.
11
Задание на обработку результатов
1.Вычислить по формуле (2.1) показатель политропы n. Рассчитать доверительную погрешность ∆n, используя методы вычисления погрешностей косвенных измерений. Результат представить в виде n = < n > ± ∆n.
2.Построить nVT- и SVT-циклы в координатах (р, V), для чего вычислить неизвестные значения ∆V12, ∆T23, ∆V12*, ∆T23* с помощью уравнений политропного и адиабатного процессов. При расчётах использовать экспериментально полученные значения давления и величину p2. Графики построить на миллиметровой бумаге в удобном масштабе.
3.По формулам (2.2) и (2.3) рассчитать мольную теплоёмкость воздуха в политропном процессе и мольную изохорную теплоёмкость воздуха.
4.Рассчитать холодильные коэффициенты для nVT- и SVT-циклов. Сравнить значения холодильных коэффициентов, полученные расчетным путем, с холодильными коэффициентами обратимого цикла Карно, построенного в пределах тех же максимальных и минимальных температур циклов, т. е. Т1, Т2 и Т2* соответственно. Обратите внимание, что холодильные коэффициенты обратимых циклов Карно меньше, чем холодильные коэффициенты рассматриваемых циклов.
5.Используя уравнения состояния идеального газа, найти число молей воздуха в сосуде ν по известным значениям p2, V1, T1. Считается, что число молей газа – постоянная величина.
6.Рассчитать изменение энтропии и построить nVT- и SVT-циклы в координатах (T, ДS).
Контрольные вопросы
1.Какие величины называются параметрами состояния?
2.Объясните, почему теплоёмкость газа при постоянном давлении больше, чем при постоянном объёме.
3.Как изменится величина сV, если рабочий газ считать состоящим из трехатомных молекул?
4.Чему равен показатель политропы при изохорном, изобарном и изотермическом процессах?
5.При каком процессе работа, совершаемая идеальным газом, всегда равна нулю?
6.Чему равны давление, объём, температура газа при нормальных условиях? Рассчитать величину газовой постоянной.
12
