
Лабораторная работа №3
.DOCСАНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
кафедра Физической химии
Отчет по лабораторной работе № 3
“Скорость химических реакций”
выполнил
студент гр. 6361 Драгун В.А.
преподаватель: Рубцов Эдуард Русланович
СПб 1997
Цель работы: изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции
Закон действующих
масс: при постоянной температуре
скорость химической реакции прямо
пропорциональна произведению концентраций
реагирующих веществ. Для реакции
типа A+B2![]() AB2
закон действующих масс: v=k[A][B2].
Условием протекания реакции является
столкновение молекул, однако результативными
оказываются те столкновения, в которых
принимают участие так называемые
“активные” молекулы. При повыщении
температуры энергия вещества возрастает
и перераспределяется между молекулами
таким образом, что значительно
увеличивается число активных молекул,
то есть таких молекул, которые в момент
столкновения обладают некоторым избытком
энергии над средней энергией частиц.
Энергия активации - минимальная энергия,
которой должны обладать реагирующие
частицы, чтобы столкновение между ними
привело к реакции.
AB2
закон действующих масс: v=k[A][B2].
Условием протекания реакции является
столкновение молекул, однако результативными
оказываются те столкновения, в которых
принимают участие так называемые
“активные” молекулы. При повыщении
температуры энергия вещества возрастает
и перераспределяется между молекулами
таким образом, что значительно
увеличивается число активных молекул,
то есть таких молекул, которые в момент
столкновения обладают некоторым избытком
энергии над средней энергией частиц.
Энергия активации - минимальная энергия,
которой должны обладать реагирующие
частицы, чтобы столкновение между ними
привело к реакции.
Опыты:
-
В три большие пробирки налить 2%-ный раствор Na2S2O3 и воду. Затем в три маленькие пробирки налить по 5мл 2%-ного раствора H2SO4. В первую большую прилить 5мл раствора H2SO4 (из маленькой пробирки) и замерить, через сколько секунд t1 после сливания растворов наблюлается появление серы (помутнение раствора ). С последующими пробирками проделать аналогичные опыты, замерить время t2 и t3.
-
Налить в одну пробирку 10мл раствора Na2S2O3 , в другую 10мл раствора H2SO4. Обе пробирки закрепить зажимами с деревянными рукоятками и опустить в водяной термостат. После выдержки пробирок в термостате слить водержимое обеих пробирок, засечь время Т1 от момента сливания до помутнения раствора. Проделать аналогичные опыты при температуре Т2=Т1+100, Т3=Т2+100.
Концентрация
Na2S2O3 вычисляется по
формуле
![]() ,
где a, b, c - объемы растворов соответственно
Na2S2O3, H2O, H2SO4.
,
где a, b, c - объемы растворов соответственно
Na2S2O3, H2O, H2SO4.
|
Номер опыта |
Объем Na2S2O3(а), мл |
Объем H2O(b), мл |
Объем H2SO4(с), мл |
Концентрация
|
Время, с |
Отн скор реакции |
|
1 |
5 |
10 |
5 |
0,25 |
171 |
1 |
|
2 |
10 |
5 |
5 |
0,50 |
106 |
1,6132 |
|
3 |
15 |
0 |
5 |
0,75 |
65 |
2.6308 |
|
Номер опыта |
Объем Na2S2O3, мл |
Объем H2SO4, мл |
Температура |
Время, с |
Отн скор реакции |
|
1 |
10 |
10 |
19 |
64 |
1 |
|
2 |
10 |
10 |
29 |
42 |
1,5238 |
|
3 |
10 |
10 |
39 |
19 |
3,3684 |
Построим графики зависимости скорости от концентрации и температуры:
Рассчитаем энергию
активации по уравнению
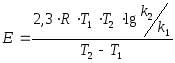 на основании изменения скорости реакции
при двух температурах.
на основании изменения скорости реакции
при двух температурах.
![]() кДж
кДж
Выводы: в результате проведения лабораторной работы убедились в том, что увеличение концентрации реагирующих веществ и их температуры приводит к увеличению скорости реакции.
