
Лаба №1Определение эквивалентной массы металла
.doc
Определение
эквивалентной массы металла![]()
Цель работы: определение эквивалентной массы металла, которая находится методом вытеснения водорода из раствора кислоты.
Основные теоретические положения: эквивалентом вещества называется такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой называется масса одного эквивалента вещества.
Формулы для вычисления, перечень символов: Согласно закону эквивалентов массы, вступающие в реакцию веществ, пропорциональны эквивалентам этих веществ:
![]() , где
М1 и М2 – массы реагирующих веществ, кг;
Э1 и Э2 – их эквиваленты.
, где
М1 и М2 – массы реагирующих веществ, кг;
Э1 и Э2 – их эквиваленты.
Эквивалентная масса элемента:
Э = А/n , где А – масса одного моля атомов элемента;
n – его валентность.
Методика эксперимента
-
Получили навеску опилок металла у преподавателя.
-
Перед началом опыта проверили сосуд на герметичность.
-
Подготовили эвдиометр для собирания водорода. Заполнили его до краев водой (с помощью стакана), зажали открытый конец пальцем и, перевернув, погрузили в чашку с водой.
-
С помощью мерного цилиндра отмерили 5 мл раствора соляной кислоты HCl (в объемном соотношении I:I), влили ее через воронку в пробирку так, чтобы не замочить стенки изнутри. Держа пробирку в слегка наклонном положении, поместили внутрь на сухую стенку навеску опилок металла в папирусной бумаге, закрыли пробирку пробкой и конец газоотводной трубки подвели под водой внутрь эвдиометра.
-
Повернули пробирку в вертикальное положение (навеска металла при этом упала в кислоту) и поставили в деревянный штатив. После окончания химической реакции (прекращение выделения пузырьков газа) дали охладиться системе до комнатной температуры в течении 8-10 минут.
-
Атмосферное давление записали по показаниям барометра:
1 мм рт. ст. = 1, 333 · 102 Па
763 мм рт. ст. = 1001707,9 Па
-
Комнатную температуру зафиксировали ртутным термометром:
22 ºС + 273 = 295 К
-
Значение парциального давления водяных паров h при температуре комнаты нашли по таблице:
h = 2643,3 Па
-
Объем полученного водорода Vt = 31 · 10-6 привели к нормальным условиям:
![]() ;
;
![]()
V0 – объем выделившегося водорода при нормальных условиях (Т0 = 273 К, Р0 = 101325 Па), м3
РН2 – парциальное давление водорода, Па;
Т – температура опыта.
-
Используя закон эквивалентов, рассчитали эквивалентную массу металла:
ЭМе / 0,0112 = mМе / V0
ЭМе
=
![]() м3/моль
м3/моль
ЭМе – эквивалентная масса металла, кг/моль;
mMe – навеска металла, кг;
0,0112 – эквивалентный объем водорода при нормальных условиях, м3/моль.
11. Вычислим по соотношению Э = А/n теоретическую эквивалентную массу металла Эт
Эт
(Zn)
=
![]() м3/моль
м3/моль
12. Вычислим абсолютную и относительную погрешности в определении эквивалентной массы металла в процентах:
![]()
Уравнение химической реакции в молекулярном и ионном виде:
2 HCl
+ Zn ZnCl2
+ H2
HCl
+ Zn ZnCl2
+ H2
2 H+
+ 2Cl-
+ Zn0
Zn2+
+ 2Cl-
+ 2H0
H+
+ 2Cl-
+ Zn0
Zn2+
+ 2Cl-
+ 2H0
2 H+
+ Zn0
Zn2+
+ 2H0
H+
+ Zn0
Zn2+
+ 2H0
Схема установки:
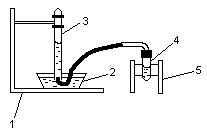
Рис 1. Схема установки: 1 – штатив; 2 – чашка с водой; 3 – эвдиометр; 4 – пробирка с газоотводной трубкой; 5 – деревянный штатив.
Экспериментальные результаты:
|
|
|
Условия опыта |
|
|
|
||
|
Навеска металла mMe, кг |
Температура Т, К |
Атмосферное давление Р, Па |
Парциальное давление водяного пара h, Па |
Объем водорода Vt, м3 |
Парциальное давление водорода РН2= Р-h, Па |
||
|
0,0880 |
295 |
101707,9 |
2643,3 |
31· 10-6 |
99064,6 |
||
Вывод: В результате работы был исследован способ определения эквивалентной массы металла, которая находится методом вытеснения водорода из раствора кислоты.
