
Лабораторная работа №1
.DOCВведение.
Цель работы: определение эквивалента металла, который находится методом вытеснения водорода из кислоты, и определение металла по этому эквиваленту.
Основные теоретические положения, лежащие в основе работы.
Эквивалентом вещества называется такое его количество, которое соединяется с одним молем атомов водорода ли замещают то же количество атомов в химических реакциях. Эквиваленоной массой называется масса одного эквивалнта вещества.
Формулы для вычислений , перечень символов.
Согласно закону эквивалентов массы, вступающие в реакцию веществ, пропорциональны эквивалентам этих веществ:
m1/Э1=m2/Э2
где m1 и m2 – массы реагирующих веществ, кг; Э1, Э2 – их эквиваленты.
Эквивалентная масса элемента
Э=А/n,
Где А –масса одного моля атомов элемента, n – его валентность.
Содержание работы.
Методика эксперимента.
-
Сборка прибора, заливание эвдиометра водой, проверка на герметичность путем нагревания руками прибирки, для будущей реакции. Наблюдается выделение пузырьков, следовательно прибор герметичен и готов к работе.
-
С помощью мерного цилиндра отмерили 5 мл раствора соляной кислоты HCl (в объемном соотношении 1:1)и влили ее через воронку в пробирку. На стенку той же наклоненной пробирки поместили опитки металла. Герметично закрыли пробирку пробкой с газоотводной трубкой. Конец газоотводной трубки подвели под водой внутрь эвдиометра.
-
Повернули пробирку в вертикальное положение. Наблюдали химическую реакцию, в результате которой в эвдиометр выделился водород.
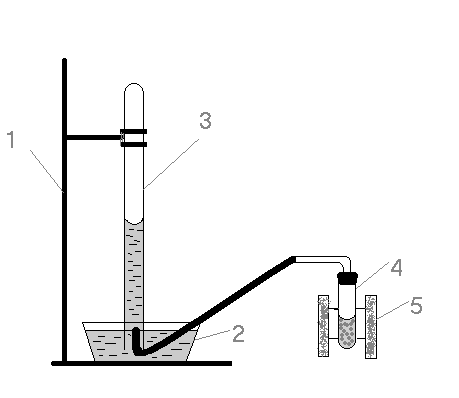
Рисунок установки.
Схема установки: 1- штатив, 2 – чашка с водой, 3 – эвдиометр, 4 – пробирка с газоотводной трубкой, 5 – деревянный штатив.
Эксперементальные результаты работы.
|
Навеска металла, кг |
Условия опыта |
Объем водорода Vt, м3 |
Парциальн. Давление PH2=P-h, Па |
||
|
Температура T, K |
Атмосферн. Давление P, Па |
Парциальное давление водяного пара h, Па |
|||
|
8,3*10-5 |
293 |
101800 |
2338,1 |
3,02*10-5 |
99461.9 |
Обработка результатов
Объем полученного водорода приводим к нормальным условиям:
P H2
Vt
P0V0
Vt
* PH2
*
273
H2
Vt
P0V0
Vt
* PH2
*
273
------------ = ----------- ; V0 = = =2.762*10-5м3
T T0 101325 T
где V0 – объем выделившегося водорода при нормальных условиях (T0=273К, P0=101325 Па ), PH2 - парциальное давление водорода,па , Т – температура опыта, К.
Расчитываем эквивалентную массу металла, используя закон эквивалентов:
ЭМе/0,0112=mMe/V0
Где ЭМе-эквивалентная масса металла, кг/моль, mMe – навеска металла, кг, 0,0112 – эквивалентный объем водорода при нормальных условиях, м3/моль
ЭМе=8,3*10-5*0,0112/ 2,762*10-5=0.034кг/моль.
ЭМе=A/n
ПредположимЮ, что исходный металл – Zn:
A=0,065кг/моль;
n=2;
ЭZn=0,065/2=0.0330.034кг/моль= ЭМе Исходный металл – цинк.
Химическая реакция :
2HCl + Zn = ZnCl2 + H2
2H+ + 2Cl- + Zn+2 = Zn+2 + 2Cl- + H2
Вывод: Ознакомился с методом определения эквивалента металла, путем вытеснения водорода из кислоты, и определения металла по этому эквиваленту.
