
- •1.Дайте определение следующим понятиям: потенциал, эдс, гальванический элемент, электроды I, II. III рода, индикаторный электрод, электрод сравнения.
- •2.Сущность метода прямой потенциометрии.
- •3.Сущность метода потенциометрического титрования.
- •4.Устройство, запись, работа электродов сравнения (каломельного, хлорсеребряного, нормального водородного).
- •5.Устройство, запись, работа индикаторных электродов кислотно-основного титрования (водородного, стеклянного, хингидронного).
- •6.Измерение эдс гальванических элементов компенсационным способами.
- •7.Устройство, запись и работа элемента Вестона.
- •8.Чему соответствуют первый и второй скачки на кривой титрования?
- •9.Объясните порядок расчёта содержания железа (№4), массовых долей кислот в их смеси (№5).
- •10. Какими преимуществами обладает метод титрования в неводных средах?
8.Чему соответствуют первый и второй скачки на кривой титрования?
Первый скачок потенциала будет соответствовать полному окислению избытка ионов олова Sn2+, а второй - окислению ионов железа Fe2+.
В процессе добавления хлорида олова (II) обесцвечивание раствора происходит вследствие протекания окислительно-восстановительной реакции:
2Fe3++Sn2+2Fe2++Sn4+
2Fe3++eFe2+
1Sn2+-2eSn4+
Для этой цели используют раствор хлорида олова II, который добавляют в раствор в небольшом избытке, что гарантирует отсутствие ионов железа III в растворе. Отсюда следует, что титруется не отдельный ион Fe2+ , а смесь ионов: Fe2+ и Sn2+ .
Действие окислителя на смесь восстановителей в первую очередь направлено на наиболее сильный из присутствующих в растворе восстановителей. В данном случае таким ионом является (Sn2+). Потенциалы участников реакции:
![]()
![]()
![]() .
.
Титрование протекает по уравнению реакции:
3Sn2++Cr2O7-2+14H+3Sn4++2Cr3+ + 7H2O
3Sn2+ - 2eSn4+ восстановитель
1Cr2O7-2+14H++6e2Cr3++7H2O окислитель.
Этому окислительно-восстановительному процессу отвечает разность стандартных ред-окс потенциалов:
![]()
Во вторую очередь бихромат калия окислит железо (II) по уравнению реакции: 6Fe2++Cr2O72-+14H+5Fe3++2Cr3+7H2O
3Fe2+ - 1eFe3+ восстановитель
1Cr2O7-2+14H++6e2Cr3++7H2O окислитель
Этому окислительно-восстановительному процессу отвечает разность стандартных ред-окс потенциалов:
![]()
В результате этих двух реакций на кривой зависимости электродного потенциала от количества прибавленного окислителя (K2Cr2O7) возникает два скачка потенциала, соответствующие точкам эквивалентности данных окислительно-восстановительных процессов.
E,мВ



V (K2Cr2O7)
т.э.1
т.э.2
Рис.11. Кривая титрования смеси ионов Fe2+ и Sn2+ раствором бихромата калия
9.Объясните порядок расчёта содержания железа (№4), массовых долей кислот в их смеси (№5).
Тогда массовую долю кислот в навеске исходной смеси можно рассчитать по формуле:
![]() ;
(30)
;
(30)
![]() ;
(31)
;
(31)
где: m – навеска смеси кислот, г.
Навеска смеси кислот определяется по разности масс бюкса со смесью кислот (mc) и пустого бюкса (mо): m=mc – mo.
ЭМ2ЭГФК = 105, ЭД2ЭГФК = 322.
10. Какими преимуществами обладает метод титрования в неводных средах?
Основным преимуществом использования неводных растворителей в качестве среды титрования для определения различных веществ является то, что в среде неводных растворителей можно дифференцированно титровать смеси электролитов, которые в водных растворах имеют близкие значения констант диссоциации, например, смеси изомеров, представителей одного гомологического рядя, кислот, оснований, солей и т.д. Дифференцированное действие растворителей определяется их кислотно-основными свойствами, способностью образовывать водородные связи, диэлектрической проницаемостью, сольватирующей способностью и т.д. Под влиянием этих свойств растворителя сила электролитов может изменятся в широких пределах, меняя тем самым константу диссоциации слабых электролитов, в частности, например, карбоновых кислот. При замене растворителя слабый электролит может превратиться в сильный и наоборот. Например, уксусная кислота в воде является слабым электролитом, тогда как в жидком аммиаке она проявляет свойства сильного электролита. Хлороводород в воде является сильным электролитом, а в гексане или бензоле является неэлекролитом.
11.Виды кривых потенциометрического титрования.
Если вычислять значение равновесного электродного потенциала по уравнению Нернста соответственно различным моментам титрования и построить график в координатах Е= f (V), ( где V - объем прибавляемого рабочего раствора ), то получится кривая отражающая динамику процесса титрования с резким изменением потенциала в точке эквивалентности. Резкое изменение потенциала (скачка титрования) в точке эквивалентности или вблизи нее даст возможность найти эквивалентную точку титрования. На точку эквивалентности четко будет указывать вертикальный участок кривой титрования

Рис. 8. Интегральная кривая потенциометрического титрования
В отдельных случаях кривая получается размытой, и точка эквивалентности отчетливо не просматривается.
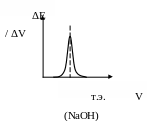
Рис. 9. Дифференциальная кривая потенциометрического титрования
Кривая строится в координатах
![]() ,
где
,
где
![]() - изменение потенциала электрода между
двумя порциями добавленного раствора,
а V порция добавленного
рабочего раствора титранта.
- изменение потенциала электрода между
двумя порциями добавленного раствора,
а V порция добавленного
рабочего раствора титранта.
Точка эквивалентности определяется как точка максимума на кривой
Кривые окислительно-восстановительного титрования могут быть построены в координатах:
рC = f(V) (титранта) или Е = f(V) (титранта),
где [C] — концентрация участника реакции,
Е — потенциал системы,
V (титранта) — объем титранта.
рC рассчитывается по уравнению рC = -lg [C].
К
 ривые
титрования первого типа рC
= f(V) представляют
практический интерес, когда имеется
индикаторный электрод, чувствительный
к измененнию концентрации потенциалобразующих
ионов. Кривые второго типа Е = f(V)
имеют более общее значение, так как
любое окислительно-восстановительное
титрование может быть проведено по
измерению Е с использованием индикаторного
электрода из благородного металла
(чаще всего платины) и электрода сравнения.
Вид кривых титрования в координатах Е
= f(V) по реакции
оисления-восстановления представлен
на рис.18
ривые
титрования первого типа рC
= f(V) представляют
практический интерес, когда имеется
индикаторный электрод, чувствительный
к измененнию концентрации потенциалобразующих
ионов. Кривые второго типа Е = f(V)
имеют более общее значение, так как
любое окислительно-восстановительное
титрование может быть проведено по
измерению Е с использованием индикаторного
электрода из благородного металла
(чаще всего платины) и электрода сравнения.
Вид кривых титрования в координатах Е
= f(V) по реакции
оисления-восстановления представлен
на рис.18
Рис. 18. Вид кривых титрования а) титруется восстановитель окислителем;
б) титруется окислитель востановителем
Вид кривых тирования зависит от природы участников реакции. Если происходит титрование восстановителя окислителем, то кривая будет соответствовать рисунку 18а. Если окислитель будет тироваться восстановителем, то титрование будет соответствовать рис. 18б.
