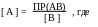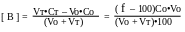- •Список рекомендуемой литературы
- •Контрольные вопросы по количественному анализу
- •Тема 1. Гравиметрический анализ
- •Тема 2. Введение в титриметрический анализ
- •Тема 3 . Кислотно–основное титрование
- •Тема 4. Окислительно–восстановительное титрование
- •Тема 5. Осадительное титрование
- •Тема 6. Комплексонометрическое титрование
- •Тема 7.Методы математической статистики в аналитической химии
- •Примеры решения типовых задач
- •3. Примеры решения задач в титриметрии.
Тема 6. Комплексонометрическое титрование
Применение полиаминокарбоновых кислот в титриметрии. Характеристика ЭДТА. Достоинства метода.
Методы определения конечной точки титрования. Металлохромные индикаторы. Принцип их использования. Характеристика важнейших универсальных и специфических индикаторов.
Комплексонометрическое определение кальция, магния, жесткости воды.
Типовые задачи:
Сборник задач и упражнений (под ред. Васильева В.П.) с. 108 N° 525, 529, 538, 549, 583.
Тема 7.Методы математической статистики в аналитической химии
Правильность и воспроизводимость результатов анализа.
Систематические и случайные ошибки. Абсолютные и относительные ошибки.
Дисперсия, стандартное отклонение, доверительный интервал, вероятная ошибка среднего результата.
Статистическая обработка результатов измерений.
Способы проверки правильности результатов измерений.
Правила обращений с приближенными числами: значащие цифры и правила округления.
Типовые задачи:
Сборник задач и упражнений (под ред. Васильева В.П.) с. 194-203.
Примеры решения типовых задач
ГРАВИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Задача 1. Вычислить фактор пересчёта для определение калия, если после осаждения его в виде K2PtCl6 получена весовая форма платина.
Дано:
Осаждаемая форма K2PtCl6
Гравиметрическая форма Pt
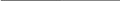
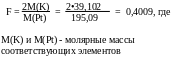
F(A) - ?
Ответ: Фактор пересчёта для определения калия равен 0,4009.
Задача 2. Рассчитать процентное содержание серебра, если из навески анализируемого сплава 0,2466 г после соответствующей обработки получили осадок AgCl 0,2675 г.
Решение:
По
справочнику находим молярные массы
веществ, необходимые
для расчета:
М(AgCl)
=
143,321
г/моль
М(Ag)
=
107,87
г/моль
Дано:
mнав. = 0,2466 г.
mос. = 0,2675 г
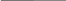
% Ag - ?

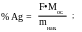
Для расчёта % Ag используем формулу:
Рассчитываем
;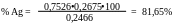
Ответ: Процентное содержание серебра в сплаве 81,65%. .
Задача 3. Сколько мл 5% раствора нитрата серебра необходимо взять для количественного осаждения хлорида серебра из 200 мл 0,01 М раствора соляной кислоты?
В
основе решения задачи лежит уравнение
реакции:
AgNO3
+
HCl
= AgCl
+
HNO3 По
уравнению реакции для осаждения Cl– из
1 моля HCl требуется 1 моль AgNO3.
Дано:
СHCl = 0,01 М
VHCl = 200 мл
В
200 мл 0,01 М HCl содержится количество
вещества (n), равное:
(AgNO3)=
5%
M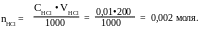 (AgNO3)
= 169,87 г/моль
(AgNO3)
= 169,87 г/моль

V(AgNO3) = ?
Значит, необходимо 0,002 моля нитрата серебра для осаждения такого же количества Cl–.
2. Переводим % концентрацию нитрата серебра в молярную:
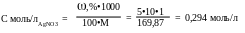
Плотность раствора нитрата серебра, учитывая приближенный характер расчётов, принимаем равной 1.
3. Находим, в каком объёме 0, 294 молярного (5%) раствора нитрата серебра содержится 0,002 моля вещества, пользуясь правилом стехиометрии.
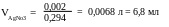
4. Поскольку нитрат серебра - нелетучее вещество, для количественного осаждения Cl- - ионов достаточно взять 30% избыток осадителя:
VAgNO3 = 6,8+2,0 = 8,8 мл.
Ответ: Для количественного осаждения хлорид-иона необходимо взять 8,8 мл нитрата серебра.
Задача 4. В каком случае при промывании осадка AgCl будут наименьшими потери:
а) 100 мл воды;
б) 100 мл 0,01 М AgNO3;
в) 100 мл 0,01 М NH4NO3.
По справочнику находим ПР (AgCl) = 1,78•10–10, М(AgNO3) = 143,32 г/моль,
Решение:
При промывании осадок частично растворяется в промывной жидкости, поэтому задача сводится к определению растворимости осадка в воде или электролитах:
а) Если осадок промывают водой:
S = ПРAgCl = 1,7•10–10 = 1,34•10–5 моль/л
Если осадок промывать 100 мл воды, потери составят 1,34•10-6 моль/л;
m (потерь) составит = 1,34•10–6 •143,32 = 1,92•10–4 г;
б) Если осадок промывают нитратом серебра, т.е. промывная жидкость содержит одноимённый ион с осадком:
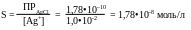
В 100 мл 0,01 М AgNO3 потери составят 1,78•10–9 моль/л,
m (потерь) = 1,78•10–9 •143,321 = 2,55•10–7 г;
в) Промывают раствором постороннего электролита NH4NO3. На растворимость будет влиять ионная сила раствора.
= 1/2cizi2 = 1/2(0,01•1+0,01•1) = 0,01.
При ионной силе 0,01 находим в справочнике значения коэффициентов активности ионов, образующих осадок:
fAg+ = fCl– = 0,89;
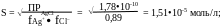
В 100 мл 0,01 М NH4NO3 потери составят 1,51•10-6 моль/л;
m (потерь) = 1,51•10–6 •143,32 = 2,16•10–4 г.
Ответ: наименьшими потери за счёт растворимости будут при использовании промывной жидкости, содержащей одноимённые ионы с осадком, т.е. раствор AgNO3.
Задача 5. При анализе оксида фосфора получены следующие результаты:
P - 43,6%, О - 56,4%. Вывести формулу соединения.
Решение:
По справочнику находим молярные массы М(Р) = 30,97 г/моль, М(О) = 16,0 г/моль. Отношение числа атомов в молекуле РxОy равно:
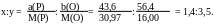
Разделив оба числа на меньшее из них, получаем x:y = 2:5
Ответ: Формула анализируемого оксида P2O5.
ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
1. О некоторых терминах и расчётах в титриметрическом методе.
При выполнении расчётов в титриметрии следует усвоить ряд понятий и ориентироваться в способах выражения концентрации растворов.
Понятие эквивалентности реагирующих веществ в химических реакциях является одним из основных понятий в химии и очень важно в аналитической химии в частности.
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквивалентность. Запишем в общем виде уравнение
аА + вВ продукты реакции.
Примем, что а>в, тогда одна условная частица вещества А (УЧ) будет эквивалентна в/а УЧ вещества В в данной рекции.
Отношение в/а является фактором эквивалентности В и обозначается f экв.(В) = в/а.
Например, в реакции: 2NaOH + H2SO4 Na2SO4 + 2H2O;
f экв.(H2SO4) = 1/2, а эквивалент серной кислоты равен 1/2 М.
В реакции NaOH + H3PO4 NaH2PO4 + H2O,
эквивалент фосфорной кислоты равен М (H3PO4), а в реакции
3NaOH + H3PO4 Na3PO4 + 3H2O,
он равен 1/3 М (H3PO4).
В окислительно-восстановительной реакции фактор эквивалентности и эквивалент рассчитывают, исходя из числа принятых или отданных электронов. Так, для дихромата калия в полуреакции:
K2Cr2O7 + 6 e + 14H+ 2K+ + 2Cr3- + 7H2O;
Э K2Cr2O7 =1/6 М (K2Cr2O7), а f экв. равно 1/6.
Масса моля эквивалентов называется "молярной массой эквивалента". Раствор, содержащий один моль- эквивалентов в литре, называется "нормальным". Так, например, для обозначения концентрации одно-нормального раствора серной кислоты можно использовать такие формы записи: 1н H2SO4 или C(f экв. = 1/2) (H2SO4) = 1моль-экв./л.
Для дихромата калия 3н K2Cr2O7 или C(f экв. = 1/6) (K2Cr2O7) = 3моль-экв./л.
Отношение молярной и нормальной концентраций данного раствора равно фактору эквивалентности. Если f экв. равен 1, то использование нормальной концентрации теряет смысл.
Стандартный раствор - раствор с точно известной концентрацией химически активного вещества или с точно известным титром.
Титр (T) - показывает, какая масса вещества (в граммах) содержится в 1 см3 его раствора. Связь титра с нормальностью можно выразить:
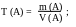
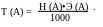
Аналогично, с молярной концентрацией:
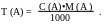
Для расчёта массы определяемого вещества в серийных анализах используют такой способ выражения концентрации, как титр рабочего раствора по определяемому веществу.
Титр по определяемому веществу Т(А/Х) (г/см3)- это отношение массы определяемого вещества м(Х) к эквивалентному объёму V(А) рабочего раствора:
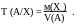
Титр по определяемому веществу Т (А/Х) показывает, какая масса анализи-
руемого вещества Х реагирует с 1 см3 рабочего раствора А. Зная Т (А/Х) (г/см3) и объём рабочего раствора V(см3), затраченного на титрование, можно рассчитать массу (г) определяемого вещества:
m(Х) = Т(А/Х)•V(А),
Титр по определяемому веществу можно рассчитать, зная нормальность титранта:
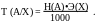
Расчёты в титриметрии базируются на эквивалентности реагирующих веществ, исходя из правила эквивалентности:
Н(А)•V(А) = Н(Х)•V(Х),
где Н(А) и Н(Х)- концентрации титранта и анализируемого вещества,
V(А) и V(Х)- объёмы этих растворов, соответственно.
При нахождении массы определяемого вещества по известным нормальной (молярной) концентрации и объёму титранта удобнее пользоваться выражением :
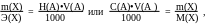
2. Построение кривых титрования.
Широко используется способ построения кривых титрования, основанный на расчёте величины изменяющегося параметра (рН, Е и т.п.) при изменении состава раствора в отдельные моменты титрования.
Для этого используют формулы зависимости величины переменного параметра от концентрации титруемого вещества или титранта. Проводится четыре типа расчётов, соответствующих различным участкам кривой:
а) до начала титрования;
б) до точки эквивалентности;
в) в точке эквивалентности;
г) за точкой эквивалентности.
По оси абсцисс откладывают либо объём титранта (мл), либо степень оттитрованности, т.е. долю оттитрованного вещества.
Степень оттитрованности f выражается отношением количества добавленного титранта к исходному количеству титруемого вещества:
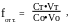
где Ст и Со- концентрации растворов титранта и титруемого вещества,
Vо- исходный объём титруемого вещества,
Vт- добавленный объём титранта.
В начале титрования f = 0, в точке эквивалентности f = 1 (100%), до точки эквивалентности f < 1 (< 100%), за точкой эквивалентности f > 1 (100%).
По оси ординат откладывают либо переменный параметр, либо его логарифм. В первом случае получается линейная кривая титрования, во втором–логарифмическая.
Линейная кривая выражается двумя прямолинейными участками, пересекающимися в точке эквивалентности. Они нашли применение для определения точки эквивалентности с помощью физико-химических методов, когда переменным параметром является какое-либо свойство, пропорциональное концентрации.
Для выбора индикатора и определения ошибки титрования более удобны логарифмические кривые титрования. Они представляют собой S- образную кривую, на которой имеются участки плавного и резкого изменения логарифма переменного параметра. Резкое изменение наблюдается вблизи точки эквивалентности, эта область называется скачком титрования . Границы скачка оценивают, исходя из заданной точности титрования.
Обычно 99,9% < f < 100,1%
Рассмотрим построение кривых титрования в кислотно-основном методе.
Изменяющимся параметром при построении кривых служит величина рН раствора. Вычисление рН проводят с точностью до сотых. Метод применим для определения концентрации кислот ( соляная, уксусная и т.п.), оснований ( гидроксид натрия, аммиак, карбонат натрия и т.п.), амфолитов ( гидрокарбонат натрия, дигидрофосфат натрия и т.п.). Рассмотрим способы вычисления рН в момент титрования, соответствующие различным участкам кривой титрования.
До начала титрования.
Раствор содержит только титруемую кислоту, рН рассчитывают по исходной концентрации кислоты, используя в зависимости от силы кислоты следующие формулы:
В случае титрования сильной кислоты:
[H+] = Co
слабой кислоты:
[H+] = K(HA)•Co, если h < 5%,
и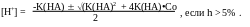 ли
ли
До точки эквивалентности.
Растворы представляют собой смесь неоттитрованной кислоты и сопряженного основания. Формула, используемая для расчёта рН, зависит от силы титруемой кислоты.
а) При титровании сильной кислоты:
б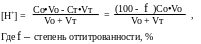 )
При титровании слабой кислоты образующиеся
растворы представляют буферные смеси.
Расчёт рН производится по формуле:
)
При титровании слабой кислоты образующиеся
растворы представляют буферные смеси.
Расчёт рН производится по формуле:
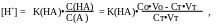
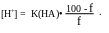
Как видно, в этой области кривой титрования рН не зависит от разбавления раствора.
В точке эквивалентности.
Раствор содержит только основание А в количестве, равном исходному количеству титруемой кислоты.
а) При титровании сильной кислоты образуется очень слабое сопряженное основание, поэтому рН раствора определяется кислотно - основными свойствами растворителя и рассчитывается по величине КH2O:
[H+] = K(H2O):
б) При титровании слабой кислоты образуется сопряженное основание с более выраженными основными свойствами, чем у растворителя, поэтому рН определяется концентрацией основания и рассчитывается по формуле:
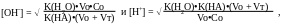
За точкой эквивалентности.
Раствор представляет собой смесь слабого и сильного оснований. Более сильное основание подавляет диссоциацию слабого, поэтому рН раствора определяется избытком добавленного титранта:
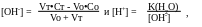
или, при использовании f:
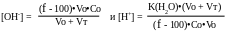
Построение кривых окислительно–восстановительного титрования.
При титровании между титрантом и титруемым веществом протекает реакция:
Ох1 + Red2 Ох2 + Red1;
Ox2 + п1е = Red1;
Ox3 + п2е = Red2.
Для каждой полуреакции в соответствии с уравнением Нернста:
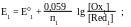
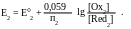
При построении кривых титрования потенциал системы до начала титрования не рассчитывается, поскольку в исходном растворе известна только концентрация одной из сопряженных форм титруемого вещества.
До точки эквивалентности.
Пусть титруемое вещество восстановитель, тогда
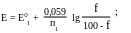
Если титруемое вещество— окислитель, то
В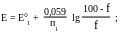 точке
эквивалентности.
точке
эквивалентности.
;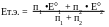
За точкой эквивалентности.
Если титруемое вещество- восстановитель, титрант- окислитель:
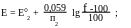
В случае, если титрант- восстановитель:
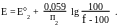
Значения стандартных потенциалов берутся в справочниках.
Построение кривых осадительного титрования.
Кривые титрования строят в координатах «lg равновесной концентрации
титруемого вещества- объём титранта (или степень оттитрованности)».
До начала титрования.
Равновесная концентрация титруемого иона А равна его исходконцентрации Со, следовательно
рА = – lg Co.
До точки эквивалентности.
Величина рА определяется концентрацией неоттитрованного иона А, поскольку растворимость образующегося соединения в условиях избытка одноимённого иона очень мала.
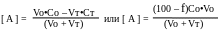
В точке эквивалентности.
Равновесная концентрация А определяется растворимостью осадка (АВ):
[ A ] = [ B ] = ПР(АВ)
(Для бинарного электролита).
В общем виде для осадка AmBm:
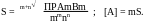
За точкой эквивалентности .
В
растворе имеется избыток титранта, т.е.
избыток одноимённых ионов В. Поэтому :