- •Химическая термодинамика
- •Часть 1
- •Термохимия
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Расчет теплоты образования твердого раствора kCl . RBr
- •Определение изменения температуры в калориметрическом опыте
- •Расчет теплоты образования кристаллогидрата
- •Контрольные вопросы
- •II. Изучение равновесия гомогенной реакции в растворе
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •III. Определение коэффициента распределения иода между органическим и неорганическим растворителями
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •3.2. Порядок выполнения работы
- •Обработка результатов эксперимента
- •Контрольные вопросы
- •IV. Изучение взаимной растворимости в трехкомпонентных системах
- •Цель работы
- •Теоретическая часть
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка экспериментальных данных
- •Контрольные вопросы
- •Литература
- •Содержание
- •Термохимия
Расчет теплоты образования твердого раствора kCl . RBr
Построить графики в координатах t, 0C = f (τ, мин) на миллиметровой бумаге для трех опытов (КBr, KCl, KCl . KBr ).
Определить графическим способом изменение температуры Δ t, как показано на рис.2, для трех опытов Δ tKCl , Δ tKBr , Δ t KCl . KBr.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.0
n
k
2.5
m
2.0
0 1 2 3 4 5 6 7 8 9 10 , мин
Рис. 2
Определение изменения температуры в калориметрическом опыте
Рассчитать постоянную калориметра, Дж/К
К =
![]() ,
,
где ΔН2
= - 17295
![]() - теплота растворения КСl,
Дж;
- теплота растворения КСl,
Дж;
ΔН1
= С![]() - тепло, теряемое на изменение температуры
раствора;
- тепло, теряемое на изменение температуры
раствора;
С = 4,18 Дж/ г . К – удельная теплоемкость раствора;
mH2O - масса воды, г.
Рассчитать молярную теплоту растворения KBr, Дж/ моль:
ΔНKBr
=
![]()
Рассчитать молярную теплоту растворения твердого раствора, Дж/моль
ΔНKBr
.KCl
=
![]()
Рассчитать молярную теплоту растворения механической смеси, Дж/моль:
ΔНKCl+KBr = NKClΔHKCl + NKBrΔHKBr,
где ΔHKCl = -17295,0 Дж/моль – молярная теплота растворения KCl;
NKCl , NKBr – мольные доли KCl и KBr:
NKCl
=
![]() ,
NKBr
=
,
NKBr
=
![]() .
.
Рассчитать теплоту образования твердого раствора по формуле (3).
Сделать выводы и оформить отчет.
Расчет теплоты образования кристаллогидрата
Построить графики в координатах t, 0C = f (τ, мин) на миллиметровой бумаге для трех опытов ( KCl, CuSO4, CuSO4 . H2O).
Определить графическим способом изменение температуры Δ t, как показано на рис.2, для трех опытов
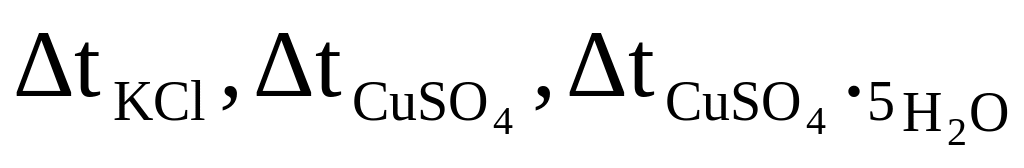 .
.Рассчитать постоянную калориметра аналогично п.4.1.3.
Рассчитать молярную теплоту растворения CuSO4, Дж/моль:
ΔНCuSO4
=
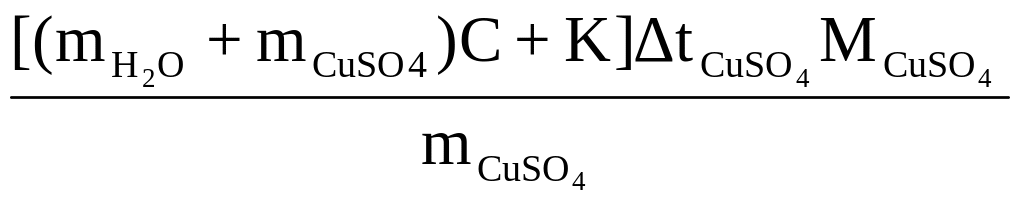 .
.
Рассчитать молярную теплоту растворения CuSO4 . 5Н2О, Дж/моль:
ΔНCuSO4
.5H2O
=
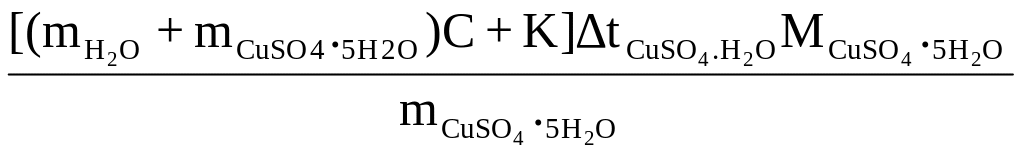 .
.
Рассчитать молярную теплоту образования кристаллогидрата ΔНCuSO4 .5H2O по формуле (5).
Сделать выводы и оформить отчет.