
- •Анализ зависимости наиболее вероятной скорости молекул от молярной массы для данной температуры .
- •Анализ зависимости наиболее вероятной скорости молекул от температуры для данного газа.
- •Расчет наиболее вероятной скорости (vв), средней квадратичной и средней арифметической скорости молекул азота. Определение доли молекул обладающих этими скоростями.
- •Сопоставление результатов расчетов, полученных с использованием калькулятора и путем интегрирования.
Институт информационных технологий БГУИР
Кафедра физико-математических дисциплин
Расчётная работа
«Закон Максвелла раcпределения молекул по скоростям»
Вариант № 25
Выполнил студент группы
№ 181012 Костров Р.М.
Проверил преподаватель
Профессор Синяков Г.Н.
Примечание Номер варианта соответствует порядковому номеру фамилии студента в списке группы.
Программу можно скачать по ссылке:
Ссылка на math_cad http://rutracker.org/forum/viewtopic.php?t=1798874
Цель работы. Анализ функции распределения молекул по скоростям в зависимости от температуры и молярной массы газа.
Теория
При изучении газов принята основная модель – модель идеального газа как большого коллектива невзаимодействующих частиц, непрерывно участвующих в беспорядочном тепловом движении. К этому коллективу частиц применим статический метод, базирующийся на математической теории вероятностей, на понятиях о средних, среднеквадратичных и наиболее вероятных параметров, характеризующих поведение частиц в коллективе.
Рассмотрим распределение Максвелла или распределение молекул по скоростям.
Скорости молекул газа имеют различные значения и направления, причем как величина, так и направление скорости каждой отдельной молекулы изменяются в результате соударений, поэтому нельзя определить число молекул, обладающих точно заданной скоростью в данный момент времени, но можно подсчитать число молекул, скорости которых лежат в интервале от v1 до v2.
При этом предполагалось, что в газе не существует молекул, имеющих в точности одинаковые скорости, и число молекул dN, скорость которых лежит в узком интервале между v и v + dv, пропорционально общему числу молекул N, ширине интервала dv и зависит от скорости v. Такая теоретическая зависимость была установлена Максвеллом на основании теории вероятностей:
dN(v)
= 4π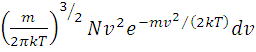 (1)
(1)
Функцию
f(v)=![]() =
4π
=
4π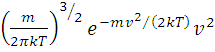 (2)
(2)
показывающую относительное число молекул, скорость которых лежит в интервале скоростей, называют функцией распределения молекул. В этой формуле: m - масса молекул, k – постоянная Больцмана, Т – абсолютная температура. Используя соотношение между постоянной Больцмана k и универсальной газовой постоянной R=kNA, формулу (2) можно переписать в виде:
f(v)=
4π (3)
(3)
где M – молярная масса газа. Эта функция удовлетворяет условию нормировки:
(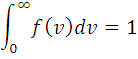 3*)
3*)
Максимум кривой распределения соответствует наиболее вероятной скорости молекул vB, которую можно найти, исследовав на максимум функцию f(v). Беря производную от функции (2) по скорости и приравнивая ее нулю, получаем
![]() =
const
=
const![]() =0,
=0,
![]() =0
=0
откуда
![]() =
=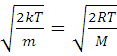 ,
(4)
,
(4)
Вид функции распределения f(v) зависит от рода газа (массы молекул) и температуры Т. Давление и объем газа на распределение молекул по скоростям не влияют.
При повышении температуры (T2>T1) vB , возрастает, поэтому максимумы кривой распределения молекул по скоростям сдвигаются в сторону больших скоростей (v2>v1); следовательно, с ростом температуры возрастает относительное число молекул, обладающих большой скоростью. Площади, ограниченные кривыми распределения при любых температурах, должны быть равны между собой, так как их величина пропорциональна общему числу молекул, которое в обоих случаях сохраняются неизменным.
Большинство молекул газа движется с наиболее вероятной скоростью, тогда как число молекул, имеющих очень малые и очень большие скорости, мало. Кроме наиболее вероятной скорости движение молекул газа характеризует:
средняя арифметическая скорость
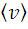 ,
определяемая формулой
,
определяемая формулой  .
.
Для дискретных значений v из общего определения средней арифметической скорости имеем
=![]()
[N - число частиц. имеющих скорость vi].
В случае непрерывного спектра значений скорости
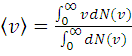 .
.
Однако
полное число частиц N
=![]() ;
следовательно,
;
следовательно,
![]() =
= ![]() .
.
Подставляя в (4) f(v) и интегрируя полученное выражение, находим
![]() =
=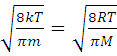 ,
(5)
,
(5)
средняя квадратичная скорость
![]() =
=
 ,
(6)
,
(6)
равна корню квадратному из среднего арифметического значения квадратов скоростей.
если все молекулы одинаковы по массе, то
vB < < .
Функцию
распределения по скоростям можно
записать в другом виде, введя понятие
относительной скорости
![]() .
Проведя математические преобразования
формулы (2), получим выражение
.
Проведя математические преобразования
формулы (2), получим выражение
![]() , (7)
, (7)
где
![]() -
доля молекул, обладающих относительными
скоростями в интервале от U до U + ΔU, ΔU
=
-
доля молекул, обладающих относительными
скоростями в интервале от U до U + ΔU, ΔU
=![]()
Порядок выполнения работы
Функция распределения рассчитана с помощью математического метода MathCad. Исследуемые соединения и их характеристики представлены в Таблице 1.
Таблица 1
№ |
Соединение |
Химическая формула |
Молярная масса (10-3кг/моль) |
Пределы изменения температуры (для пункта 2) |
1 |
гелий |
He |
4 |
273-450 |
2 |
метан |
CH3 |
15 |
300-500 |
3 |
кислород |
O2 |
32 |
220-400 |
4 |
пары воды |
H2 O |
18 |
373-500 |
5 |
неон |
Ne |
20 |
273-500 |
6 |
пары метанола |
CH3OH |
24 |
370-500 |
7 |
углекислый газ |
CO2 |
28 |
263-450 |
8 |
этан |
C2H5 |
29 |
300-500 |
9 |
азот |
N2 |
28 |
273-400 |
10 |
воздух |
|
29 |
220-450 |
11 |
закись азота |
N2 O |
36 |
283-500 |
12 |
аргон |
Ar |
40 |
300-500 |
13 |
бутан |
C3H8 |
44 |
250-450 |
14 |
пары этанола |
C2H5 OH |
38 |
363-400 |
15 |
сернистый газ |
SO2 |
48 |
250-500 |
16 |
хлор |
Cl2 |
70 |
273-400 |
17 |
пары диэтилового эфира |
C2H5 O C2H5 |
74 |
365-450 |
18 |
ксенон |
Xe |
131 |
300-500 |
19 |
пары йода |
I2 |
254 |
323-520 |
Каждый студент, выполняющий работу, рассчитывает характеристики определённого набора соединений. Номера соединений указаны в Таблице 2. Номер варианта соответствует порядковому номеру фамилии студента в списке группы.
Таблица 2.
№ варианта |
Соеденения |
№ варианта |
Соеденения |
1 |
1 6 9 11 16 18 |
17 |
9 10 11 14 18 19 |
2 |
2 7 8 12 17 14 |
18 |
5 11 14 15 16 17 |
3 |
3 8 13 18 15 5 |
19 |
2 4 7 10 18 19 |
4 |
4 9 14 19 1 11 |
20 |
3 8 9 15 2 14 |
5 |
5 10 15 18 2 12 |
21 |
1 3 4 6 12 18 |
6 |
3 1 5 7 9 11 |
22 |
4 8 9 12 16 18 |
7 |
2 4 6 13 15 17 |
23 |
6 7 11 12 13 14 |
8 |
5 7 9 11 16 18 |
24 |
3 8 11 15 16 12 |
9 |
4 8 12 18 16 5 |
25 |
2 6 12 13 15 16 |
10 |
3 9 12 15 13 7 |
26 |
3 7 8 10 13 19 |
11 |
5 7 11 16 15 9 |
27 |
1 8 9 11 15 16 |
12 |
10 2 3 4 5 11 |
28 |
2 7 8 15 16 17 |
13 |
3 4 6 8 15 18 |
29 |
3 6 7 10 11 18 |
14 |
5 9 14 17 1 14 |
30 |
4 7 10 12 15 16 |
15 |
1 3 7 12 13 19 |
31 |
5 9 11 13 17 19 |
16 |
5 6 9 13 17 18 |
32 |
1 2 7 10 11 12 |
Анализ зависимости наиболее вероятной скорости молекул от молярной массы для данной температуры .
Открыть файл Formula2.mcd
В формуле функции распределения f(v) в данном файле введены другие обозначения: молярная масса - µ, абсолютная температура – t, универсальная газовая постоянная – r.
Подвести курсор ко второй строчке и установить температуру t=400.
В первой строчке установить молярную массу первого соединения. Из кривой распределения для данной молярной массы определить наиболее вероятную скорость vв. (Скорости v отложены вдоль оси абсцисс). Для этого подведите курсор к графику и нажмите правую клавишу мыши. В предложенных функциях выберите команду “след». (В англоязычной версии - «trace…»). Далее нажимаете левую клавишу мыши на максимуме графика и в появившейся таблице определите координату на оси X.
Провести
подобную операцию для остальных объектов.
Результаты измерений занести в Таблицу
3. Вычислить ![]() .
.
Таблица 3
Молярная масса µ |
|
|
|
|
|
|
|
|
|
Наиболее вероятная скорость vв |
|
|
|
|
Построить график зависимости vв от величины .
Анализ зависимости наиболее вероятной скорости молекул от температуры для данного газа.
Выберите
одно из соединений. Установите во второй
строчке его молярную массу. Проведите
анализ зависимости vв
от температуры в пределах того диапазона
температур, которые указаны в Таблице
1. Диапазон разделите так, чтобы получилось
5 точек. Результаты запишите в Таблицу
4. Извлеките ![]() и вычислите
отношение
и вычислите
отношение ![]() .
.
Таблица 4
Соединение (укажите какое) |
Температура t |
|
|
|
|
|
|
|
|
|
|
|
|
Наиболее вероятная скорость vв |
|
|
|
|
|
|
отношение |
|
|
|
|
|
Расчет наиболее вероятной скорости (vв), средней квадратичной и средней арифметической скорости молекул азота. Определение доли молекул обладающих этими скоростями.
По
формулам (4, 5, 6) вычислите
скорости
,
![]() молекул
азота
для температуры t=
300 К. Результат занесите в Таблицу 5.
молекул
азота
для температуры t=
300 К. Результат занесите в Таблицу 5.
Проверьте условие нормировки функции (3*) для молекул азота , то есть возьмите интеграл в интервале скоростей, приведенном на графике функции распределения. (Предварительно введите параметры μ=28·10-3 , t=300). Нижний предел интегрирования установите равным 1. Результат запишите в Таблицу 5.
Используя
рассчитанные значения скоростей, путем
интегрирования определите доли молекул,
имеющих скорости vв
±
Δv;
![]() ±
Δv;
±
Δv;
![]() ±
Δv
(где Δv=5м/с).
Для этого в формулу интеграла надо
подставить нижний предел v-5
и в верхний v+5.
Результат округлите до третьей значащей
цифры и запишите в Таблицу 5.
±
Δv
(где Δv=5м/с).
Для этого в формулу интеграла надо
подставить нижний предел v-5
и в верхний v+5.
Результат округлите до третьей значащей
цифры и запишите в Таблицу 5.
Таблица 5
vв |
|
|
Условие норми-ровки |
vв±ΔV |
±ΔV |
±ΔV
|
|
|
|
|
|
|
|
Значение интеграла в пределах диапазона скоростей (*10-2) |
|
|
|
|||
Путем интегрирования определите относительное число молекул азота, которые имеют скорости, отличающиеся от vв в различных интервалах, указанных в Таблице 6.
Таблица 6
Интервал скоростей |
Числовые значения интервала скоростей |
%
|
1 - 0,5∙vв |
|
|
(0,5 - 1)∙vв |
|
|
(1 - 1,5)∙vв |
|
|
(1,5 - 2)∙vв |
|
|
(2 - 3)∙vв |
|
|
(3 - 5)∙vв |
|
|
(5 - 10)∙vв |
|
|
Из полученных данных определите:
Сколько процентов молекул имеют скорости, отличающиеся от vв не более чем на 50%.
б) Найдите отношение доли молекул, определенных в пункте а) к доли молекул, скорости которых более чем в 5 раз превышают наиболее вероятную скорость. Результаты укажите в Таблице 7.
Таблица 7
Данные расчета пункта а) |
Данные расчета пункта б) |
|
|
