
- •Лабораторный практикум по Теоретической электрохимии Кинетика электродных процессов
- •1. Описание и работа прибора
- •1.1. Назначение прибора
- •1.2. Устройство и принцип работы
- •2. Подготовка прибора к использованию
- •3. Эксплуатация прибора
- •3.1. Основные схемы включения прибора
- •3.2. Работа с программным обеспечением
- •3.3. Основные режимы работы потенциостата
- •3.4 Сохранение и перенос данных в ms Excel.
- •Работа 1. «Диффузионное перенапряжение»
- •Методика проведения эксперимента
- •Оформление результатов исследований
- •Методика проведения эксперимента
Методика проведения эксперимента
Дисковый электрод (1) приводится во вращение мотором (2) с помощью специального устройства (рис. 2). Изменение скорости вращения производится системой передач. Скорость вращения N измеряют с помощью тахометра (3). Перед проведением опытов на данной установке проверяют вращение диска и измеряют скорость вращения на разных передачах. Затем производят подготовку электрода к опыту.
Дисковый электрод представляет собой металлический стержень диаметром 5 мм, впрессованный в оболочку из тефлона. Перед каждым опытом поверхность диска при вращении шлифуют тонкой наждачной бумагой, затем промывают дистиллированной водой и протирают влажной венской известью. После этого электрод погружают на 1-2 минуты в 5%-ю серную кислоту, а затем 2-3 раза промывают, опуская в стакан с дистиллированной водой.
К этому времени ячейка (рис. 3) и раствор должны быть подготовлены к эксперименту. Ячейку соединяют с электродом, после чего снимают кривые сила тока – потенциал в гальванодинамическом режиме с помощью потенциостата.
В исследуемом растворе снимают кривые при 3-4 скоростях вращения диска (в диапазоне от 360 до 1300 об/мин). Кроме того, снимают кривую в растворе фона при скорости вращения около 1000 об/мин. Из полученных кривых строят графики зависимости i – E (плотность тока - потенциал) и iпр.–N1/2(предельная плотность тока – квадратный корень из скорости вращения диска). По величине iпр. производят расчет коэффициентов диффузии исследуемого вещества.
Вариант 1: 1) раствор фона – 0,9 н. Na2SO4 + 0,1 н. H2SO4,
2) раствор 0,05 н. CuSO4 на фоне 0,9 н. Na2SO4 + 0,1 н. H2SO4,
скорости вращения электрода: 360, 510, 670, 940 об/мин.,
скорость линейной развертки тока 0,1 мА/с.
Вариант 2: 1) раствор фона – 1н. KCl,
2) раствор 0,05 н. ZnCl2 на фоне 1н. KCl,
скорости вращения электрода: 360, 510, 670, 940, 1300 об/мин.,
скорость линейной развертки тока 0,03 мА/с.

Рис. 3. Ячейка для снятия поляризационных кривых на вращающемся дисковом электроде:
1 – исследуемый электрод d = 5 мм; 2 – вспомогательный электрод; 3 – электрод сравнения; 4 – подача инертного газа
Проведение измерений на потенциостате
а) Измеряют потенциал рабочего электрода в растворе фона в отсутствии тока. Запускают программу в режиме «Вольтметр» на 5 минут. Сохраняют полученное значение стационарного потенциала.
б) Измерения проводят в гальванодинамическом режиме. Для этого в поле программы «Развертка потенциала» поставить флажок «Гальваностатический режим». Задают параметры линейной развертки тока: Стартовый ток 0 мА Максимальный ток 0 мА Минимальный ток -20 мА Скорость развертки 0,1 или 0,03 мА/с (по заданию) Количество циклов 1 Направление развертки – Тип диаграммы i(E) – ток - потенциал Диапазон потенциала 15 В, диапазон тока 500 мА. Остановка программы развертки будет осуществляться вручную!
Скорость регистрации задать 5 точек в секунду (меню Установки\ Настройки\ Скорость регистрации\ 5 точки/с\ Применить).
Достижение предельной плотности тока обнаруживают по резкому изменению наклона кривой ток-потенциал. Выполнение программы осуществляют нажатием на кнопку «Стоп».
Сохранить данные измерения.
в) Сначала измерения проводят в растворе фона, а затем в растворе исследуемого вещества при различных скоростях вращения электрода.
Оформление результатов исследования
Поляризационные кривые, записанные в координатах I-E, перестроить в единой системе координат i-E для всех скоростей вращения электрода.
Результаты пересчета поляризационных кривых свести в таблицу по форме:
Таблица …
Результаты пересчета поляризационных кривых
Состав раствора и его концентрация…………
Температура раствора, °С……………………..
Поверхность электрода, м2…………………...
Скорость вращения N, об/мин. |
Результаты пересчета |
|||
ток I, А |
плотность тока i, А/м2 |
э.д.с., В |
Е, В (н.в.э.) |
|
Определить по графику значения iпр. для каждой скорости вращения электрода.
Построить график зависимости iпр. - ω1/2.
Рассчитать значения коэффициента диффузии для каждой скорости вращения электрода и среднее значение.
Результаты расчетов свести в таблицу по форме:
Таблица …
Результаты расчета коэффициента диффузии иона ……
Скорость вращения |
Предельная плотность тока iк, А/м2 |
iпр.ω1/2 |
Коэффициент диффузии D, м2/с |
||||
N, об/мин. |
ω, рад/с |
ω1/2 |
в данном опыте |
средний |
по литературным данным |
||
Контрольные вопросы
Первый закон Фика. Распределение концентрации ионов в приэлектродном слое.
Теория конвективной диффузии.
Изменение толщины диффузионного слоя с течением времени и при увеличении плотности тока.
Предельный ток. Влияние на него концентрации разряжающихся ионов и ионов фона, температуры, перемешивания и свойств растворителя.
Вращающийся дисковый электрод. Уравнение для предельной плотности тока.
Вывод и анализ уравнения поляризационной кривой для случая диффузионного перенапряжения в сочетании диффузионного перенапряжения с замедленным разрядом ионов.
Методы снятия поляризационных кривых.
Рекомендуемая литература
Антропов Л.И. Теоретическая электрохимия. –М.: Высш. школа, 1984, с. 313-314.
Дамаскин Б.Г., Петрий О.А. Введение в электрохимическую кинетику. –М.: Высш. школа, 1983, с. 168-173.
Работа 4. Исследование нестационарной диффузии хронопотенциометрическим методом
Хронопотенциометрия – метод исследования электрохимических процессов, основанный на определении зависимости потенциала от времени при постоянной плотности тока или при изменении ее во времени по определенному (например, линейному) закону. В условиях, когда скорость какого-либо электрохимического процесса определяется скоростью подвода реагирующего вещества к поверхности электрода из объема раствора, хронопотенциометрический метод можно использовать для аналитических целей (измерения концентрации ионов), а также для определения коэффициентов диффузии ионов и суммарного числа электронов, участвующих в электродной реакции. Анализ экспериментально полученных хронопотенциограмм дает возможность определить условия, при которых скорость электродной реакции лимитируется массопереносом.
Рассмотрим самый простой вариант хронопотенциометрического метода – так называемый гальваностатический метод (хронопотенциометрия при постоянном токе).

Рис. 1. Распределение концентрации реагирующего вещества в приэлектродной зоне раствора в разные моменты времени после включения тока постоянной плотности: t1 < t2 < t3 < t4 < t5.
На рис. 1 показано схематическое распределение концентрации реагирующего вещества в приэлектродной зоне раствора в различные моменты времени t после включения тока. Поскольку i = const, градиент концентрации у поверхности электрода (при Х → 0) должен сохраняться неизменным (см. кривые для t2, t3 и t4):
i = nFDi grad Ci, x→0, (1)
где i – плотность
n – суммарное число электронов, участвующих в электродной реакции;
Di – коэффициент диффузии i – х частиц;
Ci – их концентрация.
Эффективная толщина диффузионного слоя при этом меняется согласно уравнению:
![]() (2)
(2)
Постоянство градиента концентрации у поверхности электрода при i = const обеспечивается за счет непрерывного падения концентрации реагента у электрода:
 , (3)
, (3)
 . (3а)
. (3а)
В момент времени t4 = τ, называемый переходным временем, СiS упадет до нуля (кривая t4) и после этого grad Ci, x→0 начнет уменьшаться (кривая t5). Плотность тока рассматриваемой электродной реакции при t > τ должна постепенно уменьшаться в соответствии со снижением grad Ci, x→0. Поэтому при t > τ постоянство плотности тока на электроде поддерживается за счет протекания каких-либо других электрохимических реакций (разряда ионов фонового электролита и т.д.).
Так как при t > τ CiS → 0, то в соответствии с уравнением диффузионного перенапряжения:
![]() (4)
(4)
(индексы O и S относятся, соответственно, к объему раствора и внешней нранице двойного электрического слоя) диффузионное перенапрядение обращается в бесконечность. Действительно, на хронопотенциограмме (см. рис. 2) наблюдается скачок потенциала при t > τ. Второй участок медленного изменения потенциала определяется природой второй электрохимической реакции, доля которой в суммарной плотности тока при t > τ будет непрерывно возрастать.

Рис. 2. Гальваностатические кривые (хронопотенциограммы) при плотности тока: 1- i1 = 1,75iпр., 2- i2 = 1,25iпр.
Предполагая, что отклонение потенциала электрода от равновесного значения обусловлено исключительно изменением концентрации реагентов у поверхности электрода, т.е. рассматривая перенапряжение как чисто диффузионное, можно, комбинируя уравнение Нернста и уравнения (3) и (3а), получить уравнение, описывающее изменение потенциала во времени при t < τ (уравнение Караогланова):
 ; (5)
; (5)
при равновесии (t = 0)
![]() ; (5а)
; (5а)
Если лимитирующей
стадией какой-либо электрохимической
реакции является массоперенос, то кривые
 должны совпадать при различных значениях
i
и иметь линейный характер. Экстраполяция
прямой к оси ординат должна отсекать
на последней Et=0
= EP.
должны совпадать при различных значениях
i
и иметь линейный характер. Экстраполяция
прямой к оси ординат должна отсекать
на последней Et=0
= EP.
Экспериментальная часть
Цель работы: измерение коэффициентов диффузии ионов, суммарного числа электронов катодной реакции и определение природы лимитирующей стадии.
Схема для получения хронопотенциограмм состоит из следующих основных элементов (см. рис. 3): ячейки (1) с рабочим (2) и вспомогательным (3) электродами и электродом сравнения (4); потенциостата (5).
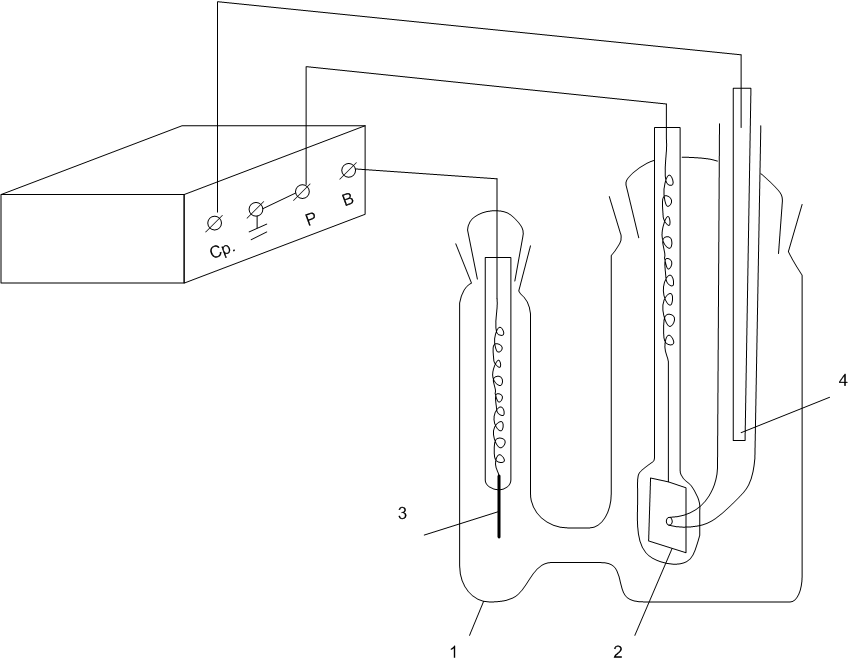
Рис. 3. Схема установки для снятия кривых E – t:
1 – ячейка с исследуемым раствором; 2 – рабочий электрод; 3 – вспомогательный электрод; 4 – электрод сравнения; 5 – потенциостат.
Получают катодные гальваностатические кривые потенциал – время (хронопотенциограммы) для электрохимических реакций, скорость которых определяется скоростью стадии диффузии реагирующих частиц к поверхности электрода. В качестве исследуемых систем используют по указанию преподавателя один из растворов:
1. K3[Fe(CN)6] – 0,02 M, K4[Fe(CN)6] – 0,02 M, KOH – 1 M. Материал рабочего электрода – платина
2. CuSO4 – 0,025 М, H2SO4 – 1 M . Материал рабочего электрода – медь (платина, покрытая медью).
Меднение платины: CuSO4 – 200 г/л, H2SO4 – 100 г/л, 10 мА, 10 минут.
Из гальваностатических кривых E-t определяют переходное время τ, рассчитывают произведение i∙τ1/2 и коэффициент диффузии восстанавливающихся ионов (Cu2+, Zn2+).
Строят хронопотенциограммы в координатах E – lg (1 – t1/2/τ1/2), определяют их наклон и рассчитывают число электронов n.
После проверки схемы и ознакомления с работой потенциостата работа выполняется в следующем порядке:
1. Подготовить к работе рабочий электрод.
Для осаждения меди на поверхность платины собирают ячейку, в которой рабочим электродом будет гладкая платина. Электроды подключают по двухэлектродной схеме: клеммы work+comp подсоединяют к рабочему электроду, counter+ref – к вспомогательному электроду. В программе в поле «Гальваностат» задают силу тока -10 мА (минус), время работы 10 минут. Нажатием на кнопку «Старт» запускают программу. Через 10 минут ячейка выключится. Рабочий электрод после нанесения покрытия промывают сначала водопроводной, затем дистиллированной водой и помещают в ячейку для снятия поляризационной кривой. После этого подключают электрод к потенциостату и измеряют стационарный потенциал рабочего электрода в отсутствие внешнего тока (Work+Comp – к рабочему электроду, Ref – к электроду сравнения, Counter – к вспомогательному электроду).
2. Снимают поляризационную кривую в исследуемом растворе при линейной развертке поляризующего тока со скоростью υi = 0,03 мА/с. В поле «Развертка потенциала» поставить флажок «Гальваностатический режим» - программа переключается в режим развертки тока. Задают:
Старт. ток 0 мА
Макс. ток –5 мА
Мин. ток –5,1 мА
Скорость развертки 0,03 мА/с
Направление развертки – (в сторону отрицательных значений)
Количество циклов 1
Остановка выполнения программы осуществляют вручную нажатием на кнопку «Стоп» при обнаружении резкого изменения потенциала (достижение предельного тока).
Из полученной поляризационной кривой определяют величину стационарного предельного диффузионного тока восстанавливающихся ионов. Рассчитывают величины токов гальваностатических кривых, которые превышают предельный диффузионный ток на 25, 50, 75, 100 и 125%.
3. Обновляют поверхность электрода вышеуказанным способом и приступают к съемке гальваностатических кривых в исследуемом растворе.
В поле программы «Гальваностат» задать требуемое значение тока (iпр.∙1,25; iпр.∙1,50; iпр.∙1,75 и т.д.) (со знаком минус) и время измерения 2 мин. Выбрать тип диаграммы E(t) – потенциал – время. Время измерения 2 минуты задается с запасом, поэтому, когда потенциал электрода перестанет сильно изменяться, остановить программу вручную. Сохранить полученные данные. Повторить измерения при большей силе тока.
Обработка результатов
Из полученных хронопотенциограмм определяют переходное время: для этого проводят касательные к линейным участкам хронопотенциограммы (до начала резкого подъема потенциала и на участке подъема) (рис. 2). Экстраполируя указанные линейные участки до их пересчения, определяют в точке пересечения время τпер. [c]. Разделив силу тока на величину поверхности электрода, находят плотность поляризующего тока i = I/S [А/см2]. Затем для каждой плотности тока рассчитывают произведение i∙τ1/2. Из среднего значения i∙τ1/2 [А/см2∙с1/2] с помощью уравнения (3а) рассчитывают коэффициент диффузии ионов металла D [см2/с], выражая концентрацию в моль/см3.
Три хронопотенциограммы, снятые при наименьшей, средней и наибольшей плотностях тока, строят в координатах E – lg (1 – t1/2/τ1/2). Определяют угловой коэффициент полученных линейных участков. Путем их экстраполяции на значения логарифма, равное нулю, находят Et=0 и сравнивают его с непосредственно измеренной величиной равновесного потенциала электрода. Делают вывод о соответствии экспериментальных хронопотенциограмм уравнению (5), которое справедливо при обратном протекании электродной реакции.
Оформление результатов исследования
1. Из поляризационной кривой, снятой в гальванодинамических условиях, определить значения предельного тока и предельной плотности тока.
2. Хронопотенциограммы построить в единой системе координат, пересчитав значения потенциала относительно водородного электрода (н.в.э.). Результаты пересчета свести в таблицу по форме 1.
3. Из полученных хронопотенциограмм определить значения переходного времени τ и рассчитать произведение i∙τ1/2 для каждой плотности тока и коэффициент диффузии (среднее значение). Результаты расчетов свести в таблицу по форме 2.
4. Три хронопотенциограммы, снятые при наименьшей, средней и наибольшей плотностях тока, построить в координатах E – lg (1 – t1/2/τ1/2). Определить тангенс угла наклона линейных участков и число электронов, участвующих в электродной реакции. Путем экстраполяции графиков на значение логарифма, равное нулю, найти потенциал Et=0 и сравнить его с измеренной величиной равновесного потенциала электрода. Результаты занести в таблицу по форме 2.
Таблица … (Форма 1)
Результаты пересчета хронопотенциограмм
Состав раствора и его концентрация…………
Температура раствора, °С……………………..
Поверхность электрода, м2…………………….
Iпр. = ……А, iпр. = ………А/м2.
I1 = ………A |
I2 = ………A |
I3 = ………A |
И т.д. |
||||||
э.д.с., В |
Ei, В |
t, с |
э.д.с., В |
Ei, В |
t, с |
э.д.с., В |
Ei, В |
t, с |
|
Таблица ….(Форма 2)
Результаты расчета переходного времени и коэффициента диффузии
Ток I, A |
Плотность тока i, А/м2 |
τ, с |
τ1/2, с1/2 |
iτ1/2, (Ас1/2/м) |
D, м2/с |
Et=0, В |
tgα = 2,3RT/nF |
Число электронов |
||
опытное |
среднее |
опытное |
|
|||||||
Контрольные вопросы
1. Распределение концентрации в приэлектродной зоне раствора при гальваностатически условиях нестационарной диффузии к плоскому электроду.
2. Изменение эффективной толщины диффузионного слоя и концентрации реагирующего вещества у поверхности электрода с течением времени.
3. Переходное время – связь с изменением концентрации у поверхности электрода и электродного потенциала.
4. Уравнение Караогланова.
5. Установление диффузионной природы лимитирующей стадии методом анализа хронопотенциограмм.
Рекомендуемая литература
Антропов Л.И. Теоретическая электрохимия. –М.: Высш. школа, 1984, с. 146-149, 303-319.
Дамаскин Б.Г., Петрий О.А. Введение в электрохимическую кинетику. –М.: Высш. школа, 1983, с. 147-152, 211-216.
