-
Практическая часть
Теоретическая часть:
-
Трифенилметильная (тритильная) группа широко используется для избирательной защиты пространственно более доступных первичных гидроксильных центров. Она легко вводится в молекулу действием трифенилметилхлорида в присутствии органических оснований, устойчива в щелочной среде и защищает гидроксильную группу от действия нуклеофильных реагентов. Удаляют тритильную защиту кислотным гидролизом.
-
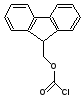
Для синтеза в растворе достаточно часто используют защитные группы уретанового типа. Преимущество этого типа защитных групп состоит в том, что на стадии активирования N-защищенных аминокислот, на стадии образования пептидных связей и во время различных обработок пептидов практически отсутствует рацемизация аминокислот. Одной из наиболее используемых защитных групп уретанового типа является: 9-флуоренилметилоксикарбонильная группа (Fmoc-). Удаляется мягкими основаниями, например, 20% раствором пиперидина и является ортогональной по отношению к кислотолабильным защитным группам.
Методика реакций:
-
Синтез Fmoc-Cys (Trt)
1 г (2,74 моль) тритилцистеина растворили при перемешивании в 10% растворе карбоната натрия (50 мл), охлаждая на ледяной бане. Затем добавили диоксан (3 мл) и медленно прибавляли раствор 780 мг (3,01 моль) 9-флуоренилметилхлорформиат в диоксане (10 мл). Перемешивали 1 час при 0°C, затем 4 часа при комнатной температуре. Реакционную смесь разбавили до 250 л ледяной водой и экстрагировали диэтиловым эфиром (3х70 мл). Водный слой после охлаждения подкисляют HCl до рН=2,0 и экстрагировали этилацетатом (4х70 мл). Объединенные органические фракции промывали 0,1н HCl и сушили над сульфатом натрия. После удаления осушителя и упаривания кристаллизуют в гексане.
|
Формула, название |
Молярная масса |
Масса |
Объем |
Кол. вещества |
|
Тритилцистеин
|
363,47 г/моль |
1000 мг |
- |
2,74 ммоль |
|
Na2CO3 |
105,99 г/моль |
|
50 мл |
|
|
FmocCl
|
258,7 г/моль |
780 мл |
|
3,01 ммоль |
|
Диоксан
|
88,1 г/моль |
|
3 мл 10 мл |
|
Реакция:

N- (9-флуоренилметоксикарбонил) -S-тритил-L-цистеин
Проверяли на ТСХ. Система-хлороформ (9,9 мл): метанол (0,1 мл): уксусная кислота (0,1 мл).
Rf=0.59
Тпл=170°C
Выход соединения: 0,46 г
-
Синтез S-тритил-L-цистеина.
Смесь 754 мг (4.74 ммоль) хлоргидрата L-цистеина, 1300 мг (4.99 ммоль) трифенилметанола и 0.7 мл (5.57 моль) эфира трифторида бора в ледяной уксусной кислоте (25 мл) нагревали 30 мин на глицериновой бане при температуре около 85°C при интенсивном перемешивании, далее перемешивали 45 мин при комнатной температуре и переносили в стакан с 7,5 мл этанола. В реакционную массу добавляли воду (3,75 мл) и ацетат натрия (1,5 г), далее воду (12,5 мл) и ждали выпадения кристаллов. В реакционный раствор с выпавшими кристаллами добавляли холодную воду и этанол. После чего выпавшие кристаллы белого цвета отфильтровывали на воронке, промывали водой, ацетоном и эфиром.
|
Формула, название |
Молярная масса |
Масса |
Объем |
Кол. вещества |
|
CyS-HCl |
159 г/моль |
754 мг |
- |
4,74 ммоль |
|
TrOH |
260,3 г/моль |
1300 мг |
|
4,99 ммоль |
|
BF3*Et2O |
142 г/моль |
791 мл |
0,7 мл |
5,97 ммоль |
Проверяли на ТСХ. Система: хлороформ (6,8 мл) :метанол (3 мл) :аммиак (0,2 мл) :
Rf=0.7
Проверяли температуру плавления: Tпл=161 °C
Выход соединения: 1.434 г (75%).