- •7. Основи молекулярно-кінетичної теорії ідеальних газів.
- •7.1. Рівняння стану ідеальних газів.
- •7.2. Ізопроцеси.
- •7.3. Внутрішня енергія ідеального газу.
- •8. Елементи термодинаміки.
- •8 .1. Робота газу.
- •8.2. Перший закон термодинаміки.
- •8.3. Адіабатний процес.
- •8.4. Циклічні процеси. Тепловий двигун. Холодильна машина.
- •8.5. Зміна ентропії у термодинамічних процесах.
- •9. Явища переносу.
- •10. Реальні гази
- •10.1. Рівняння стану реального газу.
- •10.2. Критичний стан.
- •Задачі для самостійного розв’язання.
- •11. Фазові перетворення. Насичена пара. ВЛастивості рідин
- •12. Елементи статистики. Розподіл молекул по швидкостям та енергіям.
- •Графічні задачі і приклади тестових запитань
- •Перелік рекомендованої літератури.
8.2. Перший закон термодинаміки.
Якщо
робочому тілу (газу) надати кількість
тепла
![]() ,
відбувається зміна його внутрішньої
енергії на величину
,
відбувається зміна його внутрішньої
енергії на величину
![]() ,
і газ виконує елементарну роботу
,
і газ виконує елементарну роботу
![]() ,
причому виконується рівність, яка є
наслідком закону збереження енергії:
,
причому виконується рівність, яка є
наслідком закону збереження енергії:
![]() .
(18)
.
(18)
Елементарна робота визначена формулою (13), а зміна внутрішньої енергії для ідеального газу є повним диференціалом:
![]() .
(19)
.
(19)
(![]() – зміна температури). Звернемо увагу:
зміна внутрішньої енергії визначається
виключно параметрами початкового та
кінцевого стану газів; значення роботи,
яка виконана газом при переході із стану
1 до стану 2, залежить від ходу кривої
p(T),
тобто від характеру термодинамічного
процесу.
– зміна температури). Звернемо увагу:
зміна внутрішньої енергії визначається
виключно параметрами початкового та
кінцевого стану газів; значення роботи,
яка виконана газом при переході із стану
1 до стану 2, залежить від ходу кривої
p(T),
тобто від характеру термодинамічного
процесу.
В інтегральному вигляді перший закон термодинаміки можна представити для відомих ізопроцесів: кількість тепла, передана газу при переході із стану 1 до стану 2, визначається таким чином:
-
Ізобарний процес
( =const)
 =
=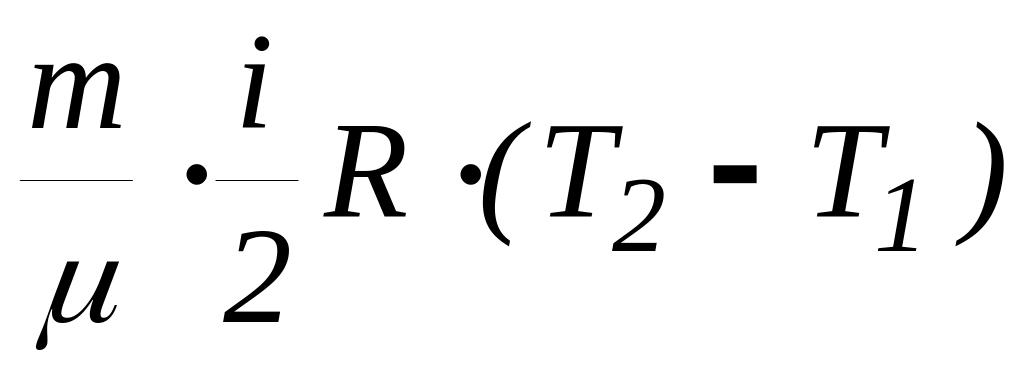 +
∙(
+
∙(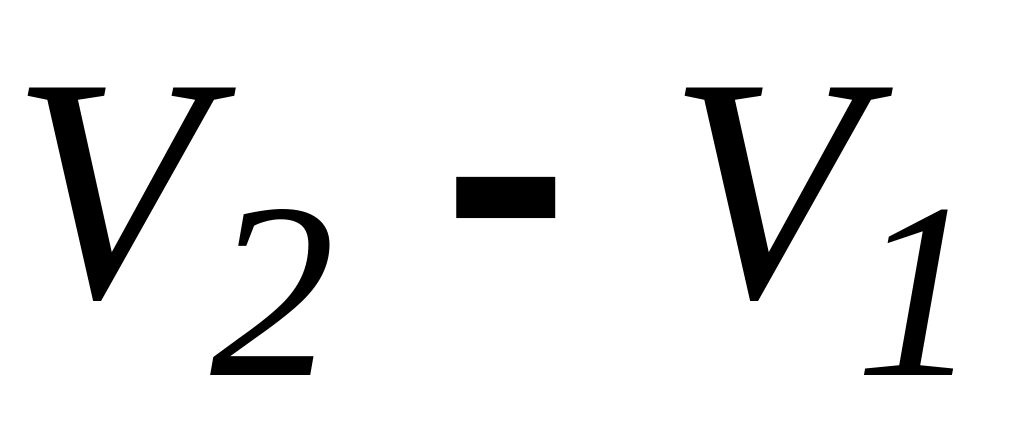 )
)(20)
Ізотермічний процес
( =const)

(21)
Ізохорний процес
( =const)
=

(22)
Теплоємністю тіла у даному термодинамічному процесі називають кількість тепла, яку необхідно надати тілу для збільшення його температури на 1 К
![]() =
=![]() .
(23)
.
(23)
Для газів вводять молярні теплоємності (для одного молю, тобто ν =1 моль)
-
При =const
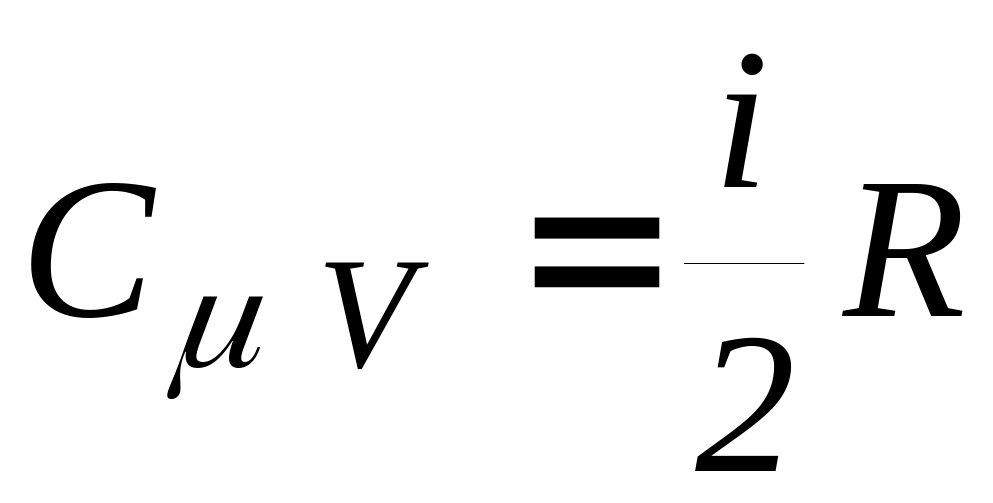
(24)
При =const
 =
=
(25)
При =const


(26)
Внутрішня енергія довільної кількості газу (енергія теплового руху молекул) таким чином може бути записана з використанням молярної теплоємності при сталому об’ємі:
![]() =
=![]()
![]() .
(27)
.
(27)
Підкреслимо, що молярна теплоємність визначається виключно числом ступенів свободи молекули газу.
Питома
теплоємність
газу
![]() (для одного
кг,
тобто
m
= 1
кг) зв’язана
з молярною теплоємністю
(для одного
кг,
тобто
m
= 1
кг) зв’язана
з молярною теплоємністю
![]() співвідношенням
співвідношенням
![]() =
=![]() .
(28)
.
(28)
8.3. Адіабатний процес.
Процес, який протікає без теплообміну з навколишнім середовищем, називають адіабатним процесом. Рівняння адіабатного процесу (рівняння Пуассону) можна записати у трьох варіантах
-
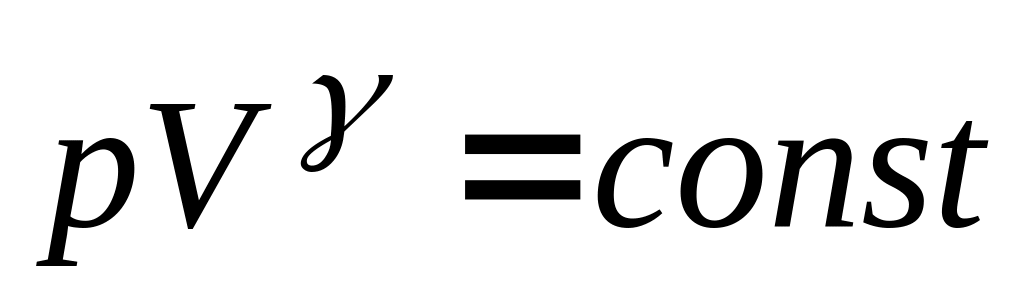
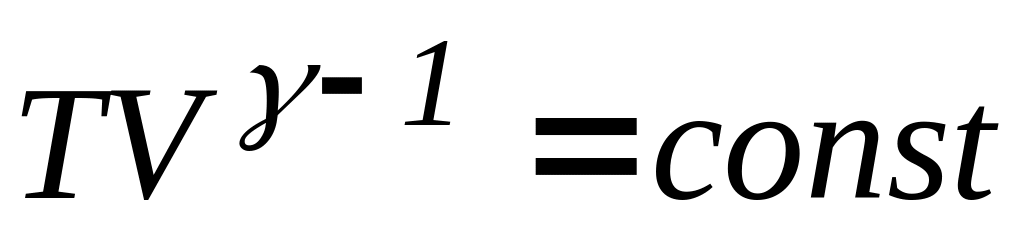
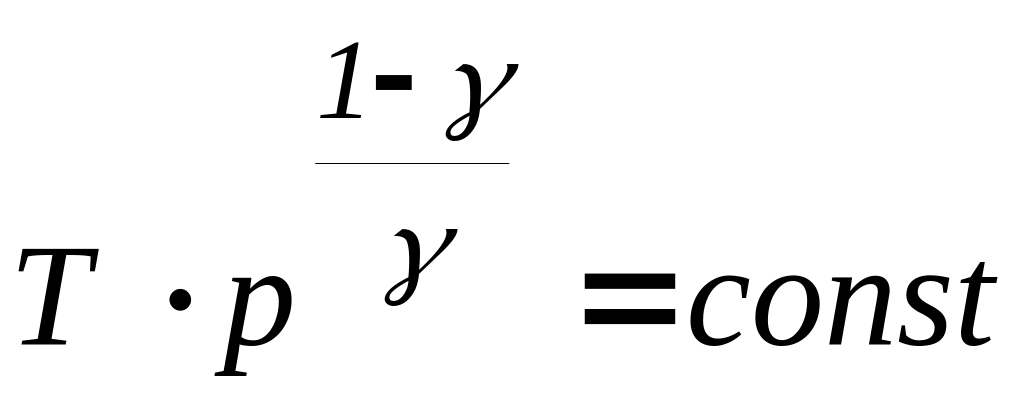
(29)
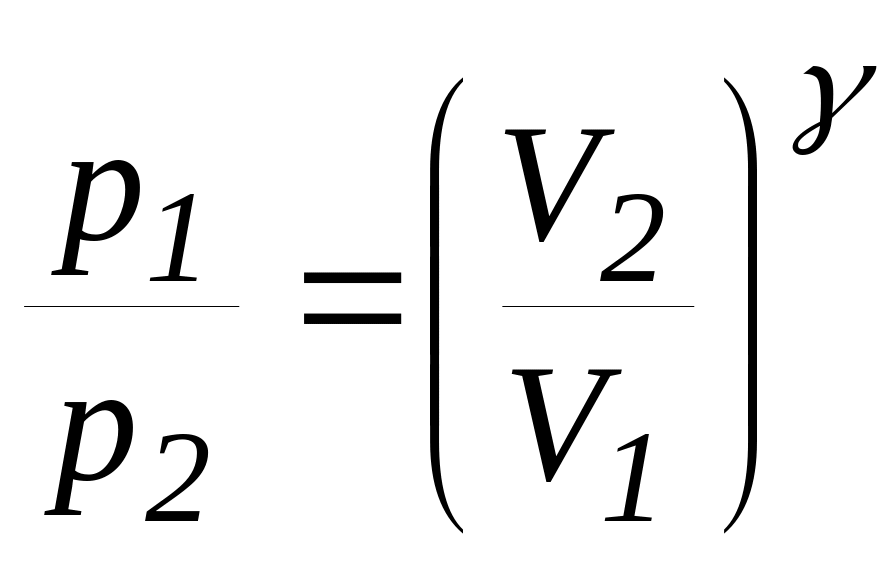

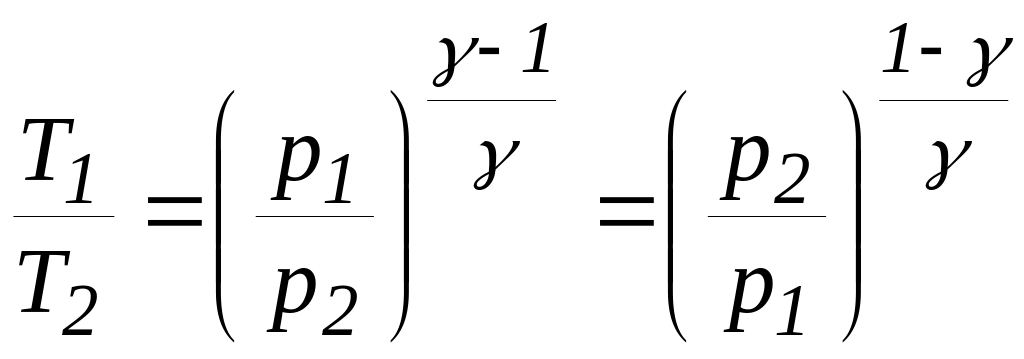
(30)
Показник
ступеню
![]() називають показником адіабати або
показником Пуассона, він представляє
собою відношення теплоємностей
називають показником адіабати або
показником Пуассона, він представляє
собою відношення теплоємностей
![]() і
і
![]() ,
отже
,
отже
![]() =
=
![]() .
(31)
.
(31)
Роботу, яку виконує газ при адіабатному переході із стану 1, що характеризують параметри ( p1,V1,T1) до стану 2 з параметрами ( p2,V2,T2 ) можна знайти по одній з трьох формул
|
|
|
|
(32) |
Застосування
першого закону термодинаміки для
адіабатних процесів.
Звернемо увагу, що для адіабатного
процесу
![]() = 0, тому вираз (18)
можна переписати у вигляді
= 0, тому вираз (18)
можна переписати у вигляді
![]() – зростання
внутрішньої енергії газу в адіабатному
процесі можливо тільки внаслідок роботи
зовнішніх сил по стисненню газу;
– зростання
внутрішньої енергії газу в адіабатному
процесі можливо тільки внаслідок роботи
зовнішніх сил по стисненню газу;
![]() – робота
розширення ідеального газу виконується
за рахунок його внутрішньої енергії і
завжди супроводжується зменшенням його
температури. (Підкреслимо, що при
розширенні ідеального газу в пустоту
робота не виконується і в адіабатному
процесі зменшення температури газу не
відбувається).
– робота
розширення ідеального газу виконується
за рахунок його внутрішньої енергії і
завжди супроводжується зменшенням його
температури. (Підкреслимо, що при
розширенні ідеального газу в пустоту
робота не виконується і в адіабатному
процесі зменшення температури газу не
відбувається).
Теплоємність адіабатного процесу дорівнює нулю.