
- •7. Основи молекулярно-кінетичної теорії ідеальних газів.
- •7.1. Рівняння стану ідеальних газів.
- •7.2. Ізопроцеси.
- •7.3. Внутрішня енергія ідеального газу.
- •8. Елементи термодинаміки.
- •8 .1. Робота газу.
- •8.2. Перший закон термодинаміки.
- •8.3. Адіабатний процес.
- •8.4. Циклічні процеси. Тепловий двигун. Холодильна машина.
- •8.5. Зміна ентропії у термодинамічних процесах.
- •9. Явища переносу.
- •10. Реальні гази
- •10.1. Рівняння стану реального газу.
- •10.2. Критичний стан.
- •Задачі для самостійного розв’язання.
- •11. Фазові перетворення. Насичена пара. ВЛастивості рідин
- •12. Елементи статистики. Розподіл молекул по швидкостям та енергіям.
- •Графічні задачі і приклади тестових запитань
- •Перелік рекомендованої літератури.
7. Основи молекулярно-кінетичної теорії ідеальних газів.
7.1. Рівняння стану ідеальних газів.
Рівняння,
що зв’язує
![]() –
об’єм,
–
об’єм,
![]() –
абсолютну температуру та
–
абсолютну температуру та
![]() –
тиск газу, називають рівнянням
стану.
Для ідеальних газів рівняння стану
Менделєєва – Клапейрона має вигляд
–
тиск газу, називають рівнянням
стану.
Для ідеальних газів рівняння стану
Менделєєва – Клапейрона має вигляд
![]() ,
(1)
,
(1)
де
![]() –
маса,
–
маса,
![]() – молярна
маса газу,
– молярна
маса газу,
![]() = 8.31
Дж/моль -
газова стала (універсальна фізична
стала). Відношення
= 8.31
Дж/моль -
газова стала (універсальна фізична
стала). Відношення
![]() =
ν має назву кількості речовини і
характеризує кількість молей газу.
Кількість молекул в одному молі всіх
газів однакова і дорівнює
=
ν має назву кількості речовини і
характеризує кількість молей газу.
Кількість молекул в одному молі всіх
газів однакова і дорівнює
![]() =
6,02∙1023
1/моль (число
Авогадро – універсальна фізична стала).
Для ν молей газу кількість молекул буде
дорівнювати
=
6,02∙1023
1/моль (число
Авогадро – універсальна фізична стала).
Для ν молей газу кількість молекул буде
дорівнювати
![]() .
Якщо
газ складається з однакових молекул
масою
.
Якщо
газ складається з однакових молекул
масою
![]() ,
то очевидно, що
=
.
,
то очевидно, що
=
.
Виходячи
з того, що густина
газу
визначається як
![]() ,
з рівняння стану можна отримати значення
,
з рівняння стану можна отримати значення
![]() при даних умовах
при даних умовах
![]() .
(2)
.
(2)
Концентрація
молекул
![]() =
=![]() зв’язана
з густиною
газу співвідношенням
зв’язана
з густиною
газу співвідношенням
![]() .
При цьому
з рівняння стану (1) можна отримати вираз
.
При цьому
з рівняння стану (1) можна отримати вираз
![]() ,
(3)
,
(3)
в
якому введена величина
![]() =
1,38∙10-23
Дж/К
-
стала Больцмана.
=
1,38∙10-23
Дж/К
-
стала Больцмана.
Для сумішей газів можна використовувати рівняння стану (1), поняття густини газу, концентрації молекул, молярної маси суміші. В основі їх коректного використання лежить закон Дальтона: тиск суміші газів дорівнює сумі їхніх парціальних тисків, тобто
![]() . (4)
. (4)
Парціальний тиск — це тиск, який чинить будь-яка з компонент суміші у відсутності усіх інших в тій самій посудині при тій самій температурі. Для знаходження молярної маси суміші треба використати визначення кількості речовини та врахувати адитивність маси і кількості речовини газу:
![]()
![]() (5),
(5),
звідки знаходимо шукану молярну масу суміші μсум.
7.2. Ізопроцеси.
Перехід газу із стану 1, який характеризують параметри (p1, V1, T1) до стану 2 з параметрами ( p2,V2,T2 ) називають термодинамічним процесом. Якщо перехід 1–2 реалізують квазістатично, тобто через послідовність рівноважних станів, то процес є оборотним, і його можна представити графічно (Рис.1). Якщо при переході 1–2 один з параметрів (p, V, T) залишається сталим, то процеси називають ізотермічним ( = const), ізобарним ( = const), ізохорним ( = const).
Рівняння для кожного ізопроцесу можна записати в одному з двох виглядів:
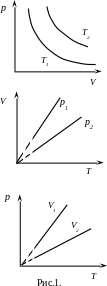



Ізотермічний ( =const)
|
|
|
(6) |
ізобарний ( =const) |
|
|
(7) |
ізохорний ( =const) |
|
|
(8) |
Значення сталих (соnst1 , соnst2 , соnst3) визначаються з рівняння стану (1).
Для
ізотермічних процесів збільшення
температури веде до зростання сталої
соnst1
і
графіки, що відповідають приведеним
функціям при (![]() ),
показані на рис.1. а.
),
показані на рис.1. а.
В
рівнянні ізобарного процесу стала
соnst2
обернено пропорційно залежить від
тиску. Тому при зростанні цього параметру
(![]() )
кут нахилу прямої
)
кут нахилу прямої
![]() зменшується (рис.1, б).
зменшується (рис.1, б).
В
рівнянні ізохорного процесу стала
соnst3
обернено пропорційно залежить від
об’єму, тому збільшення об’єму веде
до зменшення кута нахилу прямої
![]() (
рис.1, в).
(
рис.1, в).
Відповідні залежності, показані в таблиці, мають назви законів: Бойля-Маріотта (ізотермічний процес), Гей-Люссака (ізобарний процес), Шарля (ізохорний процес).
