
4.Каспазы. Каспазный каскад
Цистеиновые протеазы – каспазы (в настоящее время описано до 10 видов этих ферментов) находятся в протоплазме клеток в неактивном состоянии (в виде прокаспаз). Каспазы способны активировать друг друга, образуя разветвленный протеолитический каскад (Рис. 2). В активации прокаспаз могут участвовать и некоторые другие вещества, например, цитохром С, содержащийся в митохондриях. В конечном итоге каспазы обеспечивают фрагментацию ядра и цитоплазмы клетки, то есть являются исполнителями уничтожения клетки, за что и получили название «казнящих каспаз».
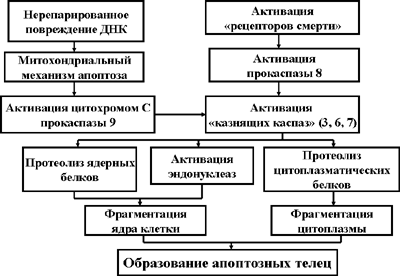
Рис. 2. Каспазный каскад
Суммируя, можно описать два основных механизма активации прокаспаз. Первый из них реализуется в случае уже описанного нерепарированного повреждения ДНК. В этом случае активация митохондриального механизма апоптоза приводит к выходу из митохондрий цитохрома С и протеазы AIF (Apoptosis Inducing Factor). Оба эти вещества участвуют в активации прокаспазы 9, которая, в свою очередь, обеспечивает активацию основной «казнящей каспазы» 3, а также каспаз 6 и 7. Активные «казнящие каспазы» завершают процесс апоптоза.
Второй путь активации каспазного каскада связан с реализацией «инструктивного механизма апоптоза» (подробнее см. в последующих разделах лекции). Возбуждение «рецепторов смерти» клетки, реализуемое при посредстве адаптерных белков, приводит к активации прокаспазы 8, которая, в свою очередь, является активатором «казнящих каспаз» 3, 6 и 7.
5.Злокачественные опухоли и апоптоз
При изучении проблем канцерогенеза было отмечено, что одним из наиболее эффективных методов борьбы организма с малегнизацией клеток является их
апоптоз. Если иммунные механизмы борьбы с клетками злокачественных опухолей включаются только тогда, когда в организме уже появились ненормальные клетки-мутанты, то апоптозный механизм реагирует на возможность малегнизации клетки уже в тот момент, когда обнаруживается первичное повреждение ДНК. В этом случае предпосылкой к активации механизмов апоптоза является отсутствие эффекта от деятельности репаразных систем, пытавшихся «залечить» повреждение ДНК. Нерепарированное повреждение ДНК благодаря пока еще мало изученным механизмам обеспечивает включение и активацию гена опухолевого супрессора р53. Повышенная же выработка белка р53 вызывает к жизни ряд последовательных событий:
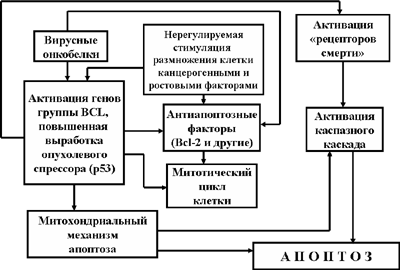
Рис. 8. Роль опухолевого супрессора р53 в борьбе с малегнизацией клеток
- активацию гена р21 и выработку белка р21, блокирующего митотический цикл на уровне G1 и G2;
- блокирование антиапоптозных факторов (в частности, белка Bcl-2 и некоторых других);
- запуск митохондриального механизма апоптоза;
- повышенный синтез «рецепторов смерти» клетки;
- завершение апоптоза благодаря активации каскада «казнящих каспаз (Рис. 8).
Так развиваются события в том случае, если развитие апоптоза опережает интенсивность пролиферации малегнизированных клеток. Однако, если антиапоптозные механизмы сохраняют жизнь клетки-мутанта, если она успевает дать начало клону своих потомков, опухоль стремительно растет со всеми печальными последствиями этого процесса.
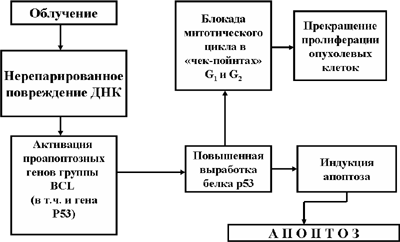
Рис. 9. Радиотерапия опухолей и апоптоз
Механизм апоптоза малегнизированных клеток используется и при радиотерапии опухолей (Рис. 9).
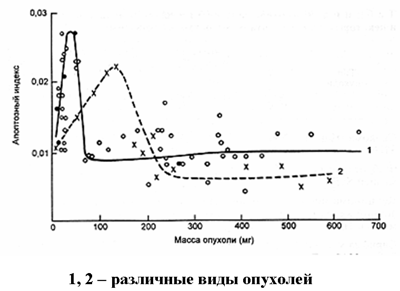
Рис. 10. Зависимость уровня апоптоза от массы опухоли (по А.Ю.Абросимову)
С другой стороны, размножившиеся опухолевые клетки начинают вырабатывать факторы борьбы с апоптозом. Именно поэтому апоптозный индекс опухоли наиболее велик в самом начале ее развития. Далее он резко падает (Рис. 10).
Список литературы:
http://ru.wikipedia.org
http://www.megabook.ru
http://meduniver.com
