
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
КАЛУЖСКОЙ ОБЛАСТИ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КАЛУЖСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ
СПЕЦИАЛЬНОСТЬ: 060108
ПРЕДМЕТ: Фармацевтическая химия
ЛЕКЦИЯ № 13
РАЗДЕЛ: 4.4.: «I и II группы периодической системы
химических элементов Д.И.Менделеева»
ТЕМА: 4.1.: «Соединения ртути»
«Соединения серебра»
РТУТИ ОКСИД ЖЕЛТЫЙ
Hydrargyri oxydum flavum
Формула: HgO
Химическое название: ртути (II) оксид
Класс соединения: основный оксид.
Получение: используют реакцию осаждения HgO из растворимых солей
ртути (HgC12 или Hg(NO3)2).
Техника выполнения: в разбавленный раствор гидроксида натрия медленно вливают концентрированный раствор соли ртути (II):


H g(NO3)2
+ 2NaHO = HgO↓ + 2NaNO3
+ Н2О
g(NO3)2
+ 2NaHO = HgO↓ + 2NaNO3
+ Н2О
конц. разб. ярко-желтый
или


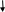
НgСl2 + 2NaHO = HgO↓ + 2NaC1+ Н2О
конц. разб.
После отстаивания сливают жидкость, осадок промывают до отсутствия щелочной реакции и высушивают.
Все операции следует проводить в темноте, т. к. на свету может образоваться Нg2O (оксид ртути (I)) — черного цвета.
Описание: желтый или оранжево-желтый, тяжелый, тонкий, аморфный порошок без запаха. На свету постепенно темнеет.
Растворимость: практически нерастворим в воде и спирте, легко растворим, разведенных соляной, азотной и уксусной кислотах.
Подлинность: открытие катиона ртути (II) – Hg2+ предварительно переведя ковалентно-связанную ртуть в ионогенное состояние. Реактивом является – калия иодид (KI).
Обоснование реакции: реакция основана на способности иона Hg 2+ с раствором калия йодида образовывать комплексные соли.
Техника выполнения: полумикрометодом:
В пробирку поместить лек. средство, прибавить для растворения разбавленную хлороводородную кислоту, затем по каплям прибавить раствор калия йодида, образуется осадок ярко-красного цвета, который растворяется в избытке реактива (KI) с образованием бесцветного раствора.
ХИМИЗМ:
HgO + 2HCl = HgCl2 + Н2О
НgСl2 + 2KI = HgI2↓ + KCl
ярко-красный
НgI2+ 2KI = K2[HgI4]
б/цв.
Тетрайодомеркурат (II) калия
Количественное определение:
Кислотно-основное титрование.
Метод ацидиметрия; титрование прямое, косвенное.
Обоснование метода.
Метод основан на способности лекарственного средства с раствором калия йодида образовывать эквивалентное количество гидроксида калия.
Характеристика метода.
Рабочий раствор — 0,1 М раствор хлороводородной кислоты. Вспомогательное вещество – калия иодид. Индикатор - метилоранж.
Техника выполнения: точную навеску лекарственного средства поместить в колбу титрования, добавить воды и раствора калия иодида до полного растворения лекарственного средства, добавить метилоранж и титровать 0,1 М раствором НСl от желтой окраски раствора до розовой.
Химизм:
Н gО
+ 4KI + Н2О
K2[HgI4]
+ 2KOH
gО
+ 4KI + Н2О
K2[HgI4]
+ 2KOH
Гидроксида калия образуется в количестве, эквивалентом лекарственному средству.
К ОН + HCl KCl + H2O
Объяснение конца титрования.
В точке эквивалентности, когда весь гидроксид калия оттитруется, избыточная капля рабочего раствора 0,1 М НС1, изменит реакцию среды в колбе на кислую и метилоранж меняет свою окраску на розовую.
Расчет ведут по формуле:
V* K*T *100
% С= ------------------------- ;
a
Хранение:
По списку «Б», в хорошо укупоренных склянках оранжевого стекла, т. к. на свету может образоваться Hg20, что обнаруживается по потемнению лекарственного средства.
Применение: как нежное антисептическое средство в глазных мазях (2%).
Формы выпуска: порошок (% содержание: не менее 99% и не более 100,5%).
Формы отпуска: мази — глазные и кожные. Мазь готовят extempore.
Назначают при блефаритах, кератитах, конъюнктивитах и т. п. и при кожных заболеваниях
(сикоз, себорея).
В глазной практике при назначении желтой ртутной мази не рекомендуется принимать одновременно внутрь соли брома и йода, ввиду возможного образования в слезной жидкости бромида и иодида ртути, обладающих прижигающим свойством.
Не рекомендуется применять и дионин.
Готовят мази по прописям:
Rp: Ung. Hydrargyri oxydi flavi 10,0
D. S. Глазная мазь.
Rp: Ung. Hydrargyri oxydi flavi 0,6
Ichthyoli 0,8
Ung. Zinci 20,0
М. F. ung.
D.S. Мазь (при сикозе).
Серебра нитрат
Argenti nitras
Формула: AgNO3 Ag –O – N = O
|
O
Класс соединения: средняя соль
Получение: растворением металлического серебра в избытке разбавленной азотной кислоты, при нагревании с последующей кристаллизацией из раствора.
3 Ag + 4НNО3 3АgNО3 + NО↑ + 2Н2О
избыток
A g0
-1ē Ag 3 восстановитель
g0
-1ē Ag 3 восстановитель
N
 O3
+ 4Н+
NO0
+
2Н2О
1 окислитель
O3
+ 4Н+
NO0
+
2Н2О
1 окислитель

Выделенные кристаллы отфильтровывают, промывают водой и высушивают в темноте.
Описание: бесцветные, прозрачные кристаллы в виде пластинок или белых цилиндрических палочек без запаха.
Под действие света лекарственное средство темнеет.
Располагается в присутствии органических соединений, несовместим с хлоридами, бромидами, иодидами.
Растворимость: очень легко растворим в воде (1:0,6), трудно в спирте (1:30).
Подлинность:
I. Открытие катиона серебра (Ag+).
1. С раствором хлороводородной кислоты или хлоридами (ГФ).
Реакция основана на способности катионов серебра с хлорид-анионами образовывать белый творожистый осадок серебра хлорида.
Техника выполнения: капельно или полумикрометодом:
К 1 мл раствора серебра нитрата прибавить 2 — 3 капли НС1 или NaC1, образуется белый творожистый осадок, нерастворимый, в азотной кислоте, растворимый в растворе аммиака.
ХИМИЗМ:
AgNO3 + NaCl = АgСl ↓ + NaNO3
(НС1)
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2Н2О
хлорид диамин серебра
Комплекс разрушается под действием азотной кислоты.
[Ag(NH3)2]Cl + 2НNО3 = АgCl + 2NН4NО3
