
- •Часть 2
- •3. Металлургия магния Свойства и области приминения магния.
- •Удельная теплоемкость жидкого магния, Дж/моль:
- •Применение
- •Минералы магния
- •Обезвоживание хлорида магния (бишофита)
- •Обезвоживание карналлита
- •Поэтому процесс ведут в две стадии
- •Хлорирование окиси магния
- •Технологические схемы Карналитовая схема
- •Магнезитовая схема
- •Смешанная схема
- •Печь кс
- •Печь скн (Рис 19, 20.)
- •Хлоратор
- •Сравнение скн и хлоратора
- •3.1.Основы электрометаллургии магния Физико-химические свойства электролитов
- •Состав используемых электролитов
- •Показатели электролиза
- •Электродные процессы. Катодные процессы.
- •Анодные процессы
- •Процессы в объеме электролита
- •Влияние различных факторов на выход по току.
- •Конструкции магниевых электролизеров. Общие сведения.
- •Диафрагменные электролизеры
- •Диафрагменный электролизер с верхним вводом анодов.
- •Диафрагменный электролизер с боковым вводом анодов
- •Диафрагменный электролизер с нижним вводом анода
- •Общие плюсы диафрагменных (относительно бездиафрагменных)
- •Общие минусы
- •Бездиафрагменный электролизер
- •Технология электролиза Питание электролизера
- •Извлечение шлама
- •Извлечение магния
- •Регулировка температуры
- •Отсос газа из электролизера
- •Поточная технология электролиза карналлита
- •3.2. Рафинирование магния
- •3.3. Производство магния термическими способами
Состав используемых электролитов
Получаются естественным путем в зависимости от используемого сырья.
1-карналлитовый (калиевый). Состав устанавливается самопроизвольно в зависимости отчастоты извлечения отработанного электролита и заливки безводного карналлита в ванну. Используется только в России.
2-магнезитовый или натриево-кальциевый целесообразно применять, когда в сырье содержится значительная примесь хлорида кальция. Когда содержание CaCl2 достигает предельной величины, часть электролита удаляют и добавляют хлорид натрия. Применяли на немецких заводах, и в СССР до прекращения производства безводного MgCl2 в ШЕП. Сейчас применяют в Норвегии, КНР, Японии и США.
3-электролит на основе MgCl2 с титанового производства.
4-универсальный, для работы по любой схеме. Натрий-калиевый электролит. Целесообразно применять при питании электролизера чистым безводным хлоридом магния, например возвратным MgCl2 с титанового производства.
Таблица 3.5 Свойства электролитов.
Состав электролита |
1 |
2 |
3 |
4 |
MgCl2 |
5-12 |
7-12 |
10-15 |
10-15 |
NaCl |
10-20 |
48-55 |
48-55 |
45-60 |
KCl |
65-85 |
4-8 |
10-15 |
30-45 |
CaCl2 |
1-5 |
35 |
- |
До 10 |
BaCl2 |
- |
- |
15-30 |
До 5 |
Тпл,С |
650-660 |
575-625 |
675-700 |
625-650 |
Плотн, г/см3 |
1,56-1,57 |
1,73 |
1,83-1,85 |
1,63 |
Разн плотн, г/см3 |
0,03-0,04 |
0,2 |
0,3-0,32 |
0,1 |
Эл-пров, 1/ом·см |
1,7-2,1 |
2,05-2,3 |
2,3-2,5 |
2,1-2,2 |
, спз |
1,6-1,8 |
2,1 |
1,5-1,6 |
1,6-1,8 |
Кол-во шлама, кг/т |
30-60 |
200-300 |
120 |
80-100 |
Предложен электролит состава 13%-MgCl2, 87%-LiCl. Это дает уменьшение удельного веса до 1,47 г/см3 и увеличение электропроводности до ~6 (1/ом·см).
Магний собирается на подине, поэтому хорошо защищен от окисления.
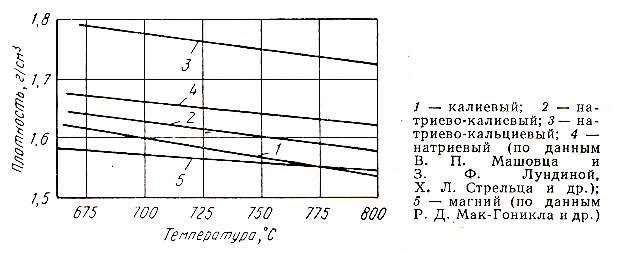
Рис.3.10. Зависимость плотности электролитов от температуры.
Показатели электролиза
1 Напряжение разложения наименьшая величина приложенной извне электродвижущей силы, при которой начинается процесс электролитического выделения вещества на электродах.
Енр=3,125-0,65·10-3Т
Е700=2,50,02 В
Eнр= -G/nF (чистое вещество, плотность тока близка к нулю)
Енр= Е+RT/nF·ln aMg2+ (для реальных условий)
Пример 1)калиевый электролит а=3,2·10-4 Енр=2,868 В
2)Na-Ca электролит а=4,3·10-4 Енр=2,670 В
2 Обратная ЭДС – ЭДС, которая будет на электролизере после откл. тока.
* Eобр=Енр + к + а
к=RT/(nF)·ln(1-ik/iпр.к)
10% мас ~1 А/см2 (в начале) , 4% - 0,4 а/см2 (в конце), 0,35 а/см2 (ведут)
к = 8,314·973/2·96484 ln (1-0,35/0,4) = 0,087 B
* фазовая поляризация связана с выделением хлора, достигает 0,3 В, Подчинена уравнению Таффеля = а + b·lg i . В реальных усл. 0,15 В.
K-ый эл-лит Еобр=3 В
Na-эл-лит Еобр=2,8 В
Eобр=Up - IR
IR=IRкат + IRэллит + IRан
В момент отключения тока величина поляризации показывает, нормально ли идет процесс.
3 Выход по току. Отношение кол-ва вещества полученного при электролизе к количеству вещества, которое должно выделится по закону Фарадея.
М теор =q·I·τ
qMg= 24,3/(2·26,8) = 0,454 г/(А·ч)
qCl = 71/(2·26,8) = 1,323 г/(А·ч)
Различают катодный и анодный выхода по току. к=80-93%, а на 2-3% больше.
4 Удельный расход эл. Энергии. Отношение фактически затраченной энергии к массе выделившегося металла.
W = IUcpτ / qMgIτт = Uср / qMgт
Uср = 4,7 В; qMg = 0,454; т = 0,9 W = 12 кВт·ч/кг
Лучшие конструкции электролизеров хар-ся
Uср = 4,2-4,3 В; т = 0,93-0,94 W ~ 10 кВт·ч/кг
5 Выход по энергии Отношение минимально возможного уд расхода эл эн к фактическому
W = Wmin/Wфакт = (Eнр/qMg·1) / Wфакт = Eнр·т / Uср
(На лучших 54%) Eнр=2,85 В.
