
- •Часть 2
- •3. Металлургия магния Свойства и области приминения магния.
- •Удельная теплоемкость жидкого магния, Дж/моль:
- •Применение
- •Минералы магния
- •Обезвоживание хлорида магния (бишофита)
- •Обезвоживание карналлита
- •Поэтому процесс ведут в две стадии
- •Хлорирование окиси магния
- •Технологические схемы Карналитовая схема
- •Магнезитовая схема
- •Смешанная схема
- •Печь кс
- •Печь скн (Рис 19, 20.)
- •Хлоратор
- •Сравнение скн и хлоратора
- •3.1.Основы электрометаллургии магния Физико-химические свойства электролитов
- •Состав используемых электролитов
- •Показатели электролиза
- •Электродные процессы. Катодные процессы.
- •Анодные процессы
- •Процессы в объеме электролита
- •Влияние различных факторов на выход по току.
- •Конструкции магниевых электролизеров. Общие сведения.
- •Диафрагменные электролизеры
- •Диафрагменный электролизер с верхним вводом анодов.
- •Диафрагменный электролизер с боковым вводом анодов
- •Диафрагменный электролизер с нижним вводом анода
- •Общие плюсы диафрагменных (относительно бездиафрагменных)
- •Общие минусы
- •Бездиафрагменный электролизер
- •Технология электролиза Питание электролизера
- •Извлечение шлама
- •Извлечение магния
- •Регулировка температуры
- •Отсос газа из электролизера
- •Поточная технология электролиза карналлита
- •3.2. Рафинирование магния
- •3.3. Производство магния термическими способами
Обезвоживание хлорида магния (бишофита)
При охлаждении или выпарке растворов хлористого магния из них осаждаются соединения хлористого магния с водой – гидраты хлористого магния. MgCl2·6H2O
Из морской воды, озерной рапы и хлормагниевого щелока получают шестиводный и четырехводный хлористый магний или их смесь (воды 40-55%). Для электролиза необходимо обезвоживание.
MgCl2·6H2O MgCl2·4H2O при 117С
MgCl2·4H2O MgCl2·2H2O при 185С
MgCl2·2H2O MgCl2·H2O при 242С
Нагреванием MgCl2·6H2O до 250С можно получить лишь MgCl2·H2O с примесью гидрооксохлорида магния (Mg(OH)Cl), дальнейший нагрев приведет к получению только окиси магния и хлористого водорода
MgCl2·H2O Mg(OH)Cl + HCl + H2O
Mg(OH)Cl MgO + HCl (554С)
Что бы предотвратить гидролиз в реакционном пространстве, необходим избыток хлористого водорода, смещающий равновесие влево.
Процесс ведут в две стадии
нагрев 115-350С, с перемешиванием, без расплавления. Продукт содержит 5-7 % MgO.
Для дальнейшего обезвоживания создаётся атмосфера с 10-12% HCl.
Обезвоживание карналлита
В две ступени
KCl·MgCl2·6H2O = KCl·MgCl2·2H2O + 4H2O (90C)
KCl·MgCl2·2H2O = KCl·MgCl2 + 2H2O (150200С)
Но при медленном нагреве превращеие 20 сопровождается значительным гидролизом (~6% при 200С, ~10% при 300С)
Поэтому процесс ведут в две стадии
1. Первичное обезвоживание в твердом состоянии при температуре 200-250С получаем обезвоженный карналит (MgCl2 – 44,6-48,3%; KCl-NaCl – 44,7; MgO – 2,1-2,5; H2O – 3,6-8,1)
Процесс ведут во вращающихся трубчатых печах (L=40м, D=2-4м, накл 2-3, 1 об/мин) с обогревом топочными газами, разбавленными воздухом до 200-250С. Производительность печи 6-7 тонн в час.
2. Расплавление и окончательное обезвоживание при 750-800С, получается безводный карналит (MgCl2 – 49-50; KCl – 42-44; NaCl – 7,5; MgO – 0,5; H2O – 0,05)
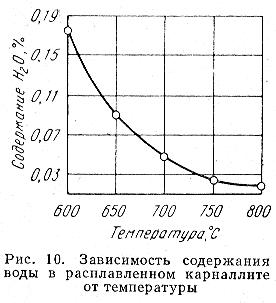
Рис 3.2. Зависимость содержания воды от температуры обезвоживания.
Реализуется в печах СКН (стационарная карналитовая непрерывного действия) или в хлораторах (содержание воды до 0,01%, нет шлама).
Полное обезвоживание карналита проводят обработкой хлором в присутствии углерода (хлорируется MgO и остаток воды).
2H2O + C + 2Cl2 = 4HCl + CO2
Хлорирование окиси магния
Реакция хлорирования окиси магния обратима и её равновесие выражается уравнением
MgO + Cl2 MgCl2 + ½ O2
Направление этой реакции зависит от концентрации хлора и кислорода в газовой фазе.
Чтобы хлорирование окиси магния протекало необратимо и достаточно быстро необходимо 1) температура не ниже 700С.
2) высокая концентрация хлора в газовой фазе
3) присутствие углерода для связывания кислорода.
Поэтому обычно хлорируют шихту – смесь окиси магния или магнезита с измельченным коксом.
MgO + C + Cl2 = MgCl2 + CO
2MgO + C + Cl2 = 2MgCl2 + CO2
Если основа шихты магнезит, то реакциям хлорирования предшествует термическое разложение магнезита MgCO3 = MgO + CO2
На практике некоторое количество окиси магния не хлорируется.
