
- •Лабораторна робота №1
- •Теоретичні відомості
- •Довжини пробігу розчинника
- •Література
- •Лабораторна робота №2
- •Теоретичні відомості
- •Кількісне визначення концентрації білків.
- •Самостійна робота студентів
- •Визначення білку біуретовим методом
- •2.Визначення білку біуретовим методом по Ярош
- •3. Визначення білку за методом Лоурі
- •Література
- •Лабораторна робота №3
- •Теоретичні відомості
- •Самостійна робота студентів
- •Нанесення точок на хроматографічний папір
- •Лабораторна робота №4
- •Теоретичні відомості
- •Будова гема
Будова гема
HN NH
Fe+2
HN NH
Центральний атом заліза Fe+2 утворює координаційні звязки з чотирма залишками пірролу. Залізо, звичайно, знаходиться в окисненій формі Fe+3.
гемопротеїн
Fe+2 е- Fe+3
відновлений стан окиснений стан
Якщо атом віддає електрони, то він переходить в окиснений стан, процес називається окисленням. Якщо проходить приєднання електронів – атом відновлюється, процес при цьому називається відновленням.
Залізопорфирини входять до складу міоглобіні, гемоглобіну, пероксидази, каталази, цитохромів.
Цитохроми або «клітинні пігменти» (вперше виявлені в кінці ХІХ століття) входять до складу ферментних білків всих типів живих організмів. Локалізовані, в основному, в мембранах, а в еукаріотів (рослини та тварини) - в мітохондріальних мембранах та ендоплазматичному ретикулумі. Всі цитохроми містять атоми заліза.
В природі відомо 25-30 різних цитохромів. Всі вони позначаються буквами a, b, c, P і т.д.
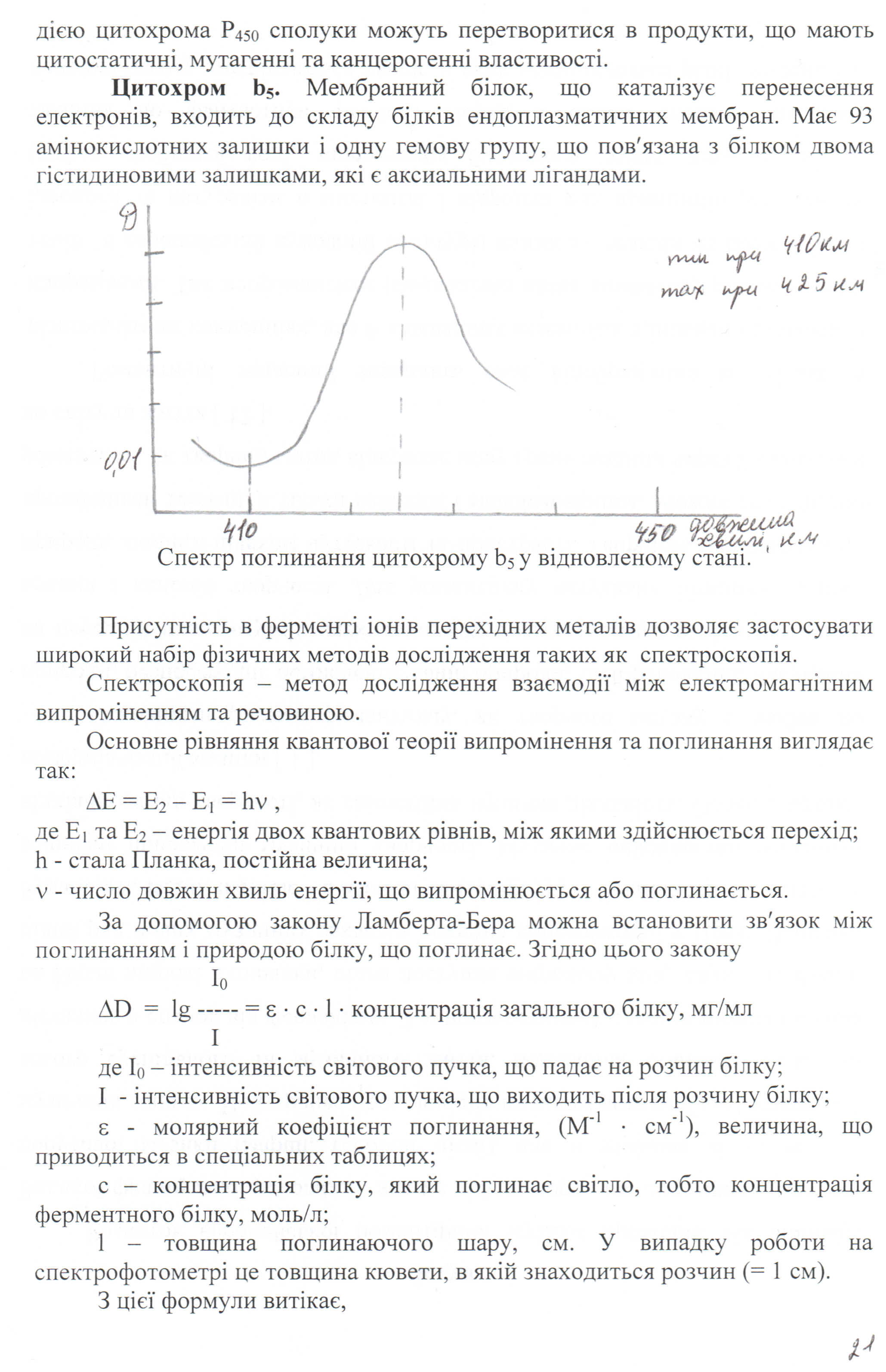
Відомо, що речовини мають властивість поглинати світло у видимій (400-700 нм) або ультрафіолетовій (200-400 нм) областях спектра. Спектрофотометр дає змогу виміряти та записати такі спектри поглинання.
Білкові речовини мають схожі спектри поглинання (білкове поглинання з максимумом при 280 нм), але часто можна виділити спектр або частину спектра характерну для даного білку. Якщо немає характерного спектру поглинання ферменту, можна скористатися специфічним субстратом, введення якого супроводжується характерними змінами в спектрі поглинання.
Вимірюючи величину поглинання цитохрому Р450 було виявлено характерне поглинання при 450 нм, що дає змогу визначити вміст цитохрому Р450 в суміші білків.
Величина поглинання вимірюється за висотою піка записаного спектрофотометром, а загальний білок – це сума всіх білків, в розчині якого знаходиться даний цитохром, визначається будь-яким методом визначення білку.
Питома і молекулярна активність.
Активність, що відноситься до одиниці ваги називається питомою, а активність в розрахунку на молекулу – молекулярною.
Питома активність виражається частіше всього в мікромолях субстрату або в наномолях субстрату перетвореного за 1 хвилину 1 мг фермента.
Молекулярна активність виражається числом молекул субстрату, перетворених за одну хвилину однією молекулою ферменту або числом

D
що с = ----------------------------------- моль/л білку проби або мілімоль/мл
l конц.заг.білку мг/мл
де D=I-I0 поглинання білкового розчину, вимірюється спектрофотометром.
Коефіцієнт молярної екстинкції або молярний коефіцієнт поглинання – це поглинання 1 М (одномолярного) розчину даної речовини або білку в кюветі товщиною 1 см
Таблиця молярних коефіцієнтів поглинання деяких цитохромів
Назва речовини |
Довжина хвилі, нм |
Молярний коефіцієнт поглинання, М-1 см-1 |
Цитохром с |
550 |
29,5 103 |
Цитохром Р420 |
420 |
110 103 |
Цитохром Р450 |
450 |
91 103 |
Цитохром b5 |
408 |
164 103 |
1 М см мл мілімоль мл
с = ------------------------------ = ---------------- = -------------------
М-1 см-1 см мгбілку/мл см мгбілку мл мгбілку
САМОСТІЙНА РОБОТА СТУДЕНТІВ
Вирахувати за спектрами поглинання D для цитохрому Р450;
Вирахувати за спектрами поглинання D для цитохрому b5;
Вирахувати концентрацію білку в розчині, якщо відомо обєм білку відомої концентрації взятий для дослідження;
Розрахувати вміст цитохромів Р450 та b5 за спектрами поглинання, якщо
відомо:
концентрацію білку у розчині;
коефіцієнт молярної екстинкції цитохрому Р450 (табличні дані);
коефіцієнт молярної екстинкції цитохрому b5 (табличні дані).
5. Написати висновок.
ЛІТЕРАТУРА
1. Овчинников Ю.А. Биоорганическая химия.- М.: «Просвещение».- 1987.- 815 стр.
2. Цыперович А.С. Ферменты.- К.: «Техніка».- 1971.- 358 стр.
3. Ленинджер А. Биохимия.- М.: «Мир».- 1974.- 957 стр.
4. Диксон М., Уэбб Э. Ферменты (в трех томах).- М.: «Мир».- 1982.
