
- •Лекція № 8 вуглеводні
- •Класифікація вуглеводнів
- •Коротка характеристика групи вуглеводнів
- •1. Алкани або насичені вуглеводні
- •Міжнародна номенклатура алканів або насичених вуглеводнів
- •Властивості алканів Фізичні властивості
- •Хімічні властивості
- •Добування алканів
- •Застосування алканів
- •2. Циклоалкани.
- •3. Ненасичені вуглеводні
- •3.1.Алкени або етиленові вуглеводні
- •Властивості алкенів або етиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування алкенів або етиленових вуглеводнів
- •Застосування алкенів або етиленових вуглеводнів
- •3.2. Алкіни (алкини) або ацетиленові вуглеводні
- •Властивості алкінів або ацетиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Дигалогенопохідне алкану
- •Добування алкінів або ацетиленових вуглеводнів
- •Застосування алкінів або ацетиленових вуглеводнів
- •3.3. Алкадієни або дієнові вуглеводні.
- •4. Арени або ароматичні вуглеводні
- •Властивості аренів або ароматичних вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування та застосування аренів або ароматичних вуглеводнів
- •Взаємоперетворення вуглеводнів
3.3. Алкадієни або дієнові вуглеводні.
АЛКАДІЄНАМИ або дієновими вуглеводнями називають органічні сполуки, в яких між атомами Карбону утворюється два подвіхних зв’язки.
Карбоновий ланцюг містить два подвійних зв’язки між атомами Карбону.
Наприклад, С = С – С – С = С;
С = С = С – С – С .
Хімічні властивості алкадієнів подібні до хімічних властивостей алкенів і алкінів.
У природі алкадієни містяться в натуральному каучуку, який добувають з соку дерева гевея та має назву латекс. У промисловості джерелом для одержання алкадієнів є природний газ та нафта. За допомогою реакції полімеризації з алкадієнів одержують синтетичні каучуки. За допомогою процесу вулканізації з канчуків одержують Ґуми.
4. Арени або ароматичні вуглеводні
АРЕНАМИ або ароматичними вуглеводнями називають ненасичені сполуки циклічної будови, які мають π - електронну спряжену систему. Загальна формула ароматичних вуглеводнів – СnH2n – 6 , де n ≥ 6. Міжнародна назва вуглеводнів – АРЕНИ. Найпростіший представник – БЕНЗЕН (або БЕНЗОЛ) – С6Н6 .
У 1865р. німецький хімік Ф. Кекуле запропонував записувати структурну формулу молекули бензену у вигляді шестичленного циклу з атомів Карбону, між якими чергуються три одинарні та три подвійні зв’язки:

Остаточно будову молекули бензену було підтверджено реакцією утворення його з ацетилену. Але таке зображення не передає справжньої будови молекули. Насправді карбон-карбонові зв'язки у бензену рівноцінні і мають властивості, не схожі на властивості ні одинарних, ні подвійних зв’язків. Ці особливості пояснюються електронною будовою молекули бензену.
14
Ознаки гомологічного ряду аренів або ароматичних вуглеводнів:
1) кожний атом карбону в молекулі бензену перебуває у стані sp2 – гібридизації. Він зв'язаний з двома сусідніми атомами Карбону і атомом Гідрогену трьома σ-зв'язками. Унаслідок цього утворюється плоский шестикутник: усі шість атомів карбону і всі σ-зв'язки С –С та С – Н лежать в одній площині. У молекулі бензену немає простих і подвійних зв'язків. Молекула бензену - стійкий шестичленний цикл з однакових СН – груп, які лежать в одній площині. Усі зв'язки між атомами Карбону у бензені рівноцінні, чим і зумовлюються характерні властивості бензенового ядра. Найточніше це відбиває структурна формула бензену у вигляді правильного шестикутника з колом всередині (І) (коло символізує рівноцінність зв'язків між атомами Карбону). Однак часто користуються і формулою Кекуле із зазначенням подвійних зв'язків (II):
2) валентний кут (α) між атомами Карбону дорівнює 1200 ; α = 120°;
3) відстань (ι) між атомами Карбону дорівнює 0,140 нм; ι = 0,140 нм;
4) найпростіша молекула аренів – бензен (бензол) має плоску будову у вигляді правильного шестикутника;
5) загальна формула аренів:
СnH2n – 6
6) назва аренів утворюється при додаванні закінчення
~ бензен (~бензол);
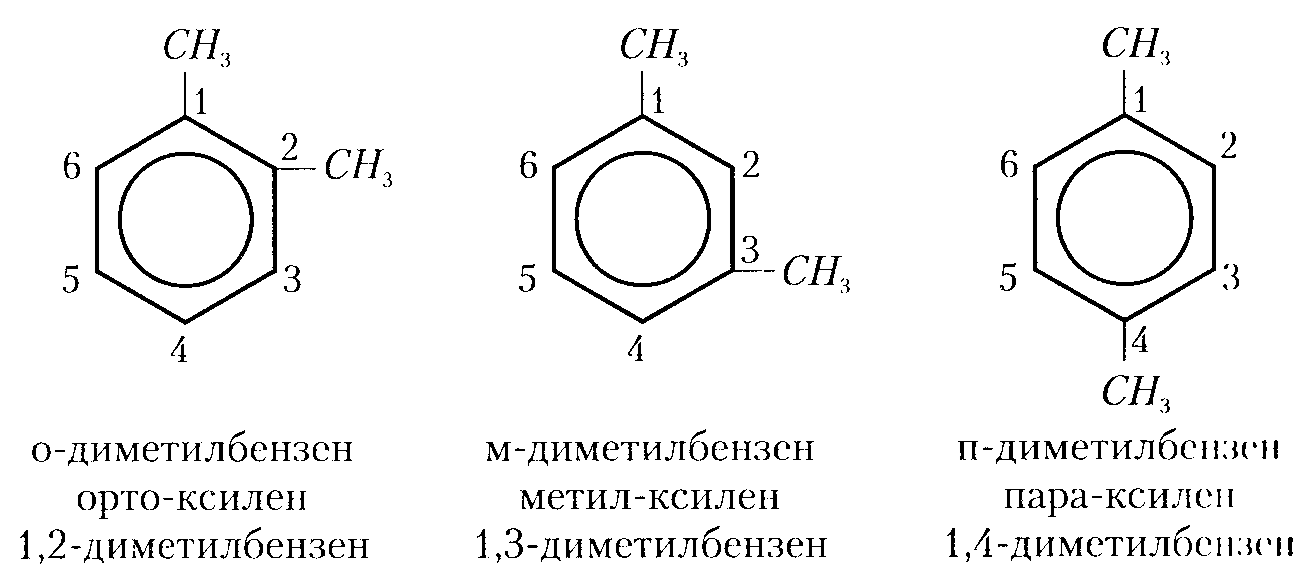
7) гомологічний ряд аренів або ароматичних вуглеводнів утворюється внаслідок заміщення атомів Гідрогену в молекулі бензену на радикали. Приклади гомологів бензену:
 Метилбензен
(метилбензол) або толуен (толуол)
Метилбензен
(метилбензол) або толуен (толуол)
15
