
- •Лекція № 8 вуглеводні
- •Класифікація вуглеводнів
- •Коротка характеристика групи вуглеводнів
- •1. Алкани або насичені вуглеводні
- •Міжнародна номенклатура алканів або насичених вуглеводнів
- •Властивості алканів Фізичні властивості
- •Хімічні властивості
- •Добування алканів
- •Застосування алканів
- •2. Циклоалкани.
- •3. Ненасичені вуглеводні
- •3.1.Алкени або етиленові вуглеводні
- •Властивості алкенів або етиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування алкенів або етиленових вуглеводнів
- •Застосування алкенів або етиленових вуглеводнів
- •3.2. Алкіни (алкини) або ацетиленові вуглеводні
- •Властивості алкінів або ацетиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Дигалогенопохідне алкану
- •Добування алкінів або ацетиленових вуглеводнів
- •Застосування алкінів або ацетиленових вуглеводнів
- •3.3. Алкадієни або дієнові вуглеводні.
- •4. Арени або ароматичні вуглеводні
- •Властивості аренів або ароматичних вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування та застосування аренів або ароматичних вуглеводнів
- •Взаємоперетворення вуглеводнів
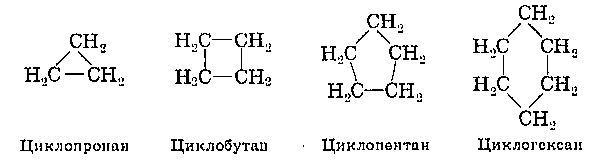
2. Циклоалкани.
3. Ненасичені вуглеводні
Ненасичені вуглеводні – це група органічних сполук , в яких між атомами Карбону утворюються кратні зв’язки. Ненасичені вуглеводні можна поділити на такі класи:

3.1.Алкени або етиленові вуглеводні
АЛКЕНАМИ або етиленовими вуглеводнями називають органічні сполуки, в яких між атомами Карбону утворюється один подвійний зв’язок.
Наприклад, С = С –С – С – С.
Ознаки гомологічного ряду алкенів або етиленових вуглеводнів:
6
1) тип гібридизації - sp2 , що вказує на утворення одного подвійного зв’язку між атомами Карбону; подвійний зв’язок складається з одного π-зв’язку ( менш міцного) та одного σ- зв’язку (міцного);
2) валентний кут (α) між атомами Карбону за місцем подвійного зв’язку дорівнює 1200 ; α = 120°;
3) відстань (ι) між атомами Карбону за місцем подвійного зв’язку дорівнює 0,134нм; ι = 0,134 нм;
4) найпростіша молекула алкенів – етен (етилен) має плоску будову;
5) загальна формула алкенів:
СnH2n
6) назва алкенів утворюється при додаванні до числівника закінчення
~ ен (~ илен);
7) гомологічний ряд алкенів або етиленових вуглеводнів:
Кількість атомів Карбону Формула Назва
n = 1 СН2 мет + ен = метен (метилен) не існує
n = 2 С2Н4 ет + ен = етен (етилен)
n = 3 С3Н6 проп + ен = пропен (пропілен)
n = 4 С4Н8 бут + ен = бутен (бутилен)
n = 5 С5Н10 пент + ен = пентен (пентилен)
n = 6 С6Н12 гекс + ен = гексен (гексилен)
n = 7 С7Н14 гепт + ен = гептен (гептилен)
n = 8 С8Н16 окт + ен = октен (октилен)
n = 9 С9Н18 нон + ен = нонен (нонилен)
n = 10 С10Н20 дек + ен = декен (декилен)
Міжнародна номенклатура алкенів або етиленових вуглеводнів
Для того, щоб назвати алкен, який має розгалужену будову необхідно користуватись такими правилами:
1) Карбоновий ланцюг нумеруємо з того боку, де ближче розташований подвійний зв’язок;
2) вказуємо розташування радикалів, називаємо їх;
3) вказуємо номер атома Карбону, з якого починається подвійний зв’язок;
4) називаємо довжину карбонового ланцюга алкену.
Властивості алкенів або етиленових вуглеводнів Фізичні властивості
Алкени трапляються в природі у значно менших кількостях, ніж алкани. Вони містяться як домішки у деяких родовищах нафти та природного газу. Багато природних сполук складної будови є похідними алкенів.
Перші чотири сполуки гомологічного ряду алкенів (С1 – С4) за звичайних умов – гази, не мають запаху; наступні одинадцять (С5 –С15) – рідини, а решта ( від С16 і т.д.) – тверді речовини без запаху. Алкени не розчинні у воді, але розчиняються в органічних розчинниках (хлороформі, бензені, етері ), легші за воду.
7
Із збільшенням молекулярної маси алкенів зростають густина, температури кипіння та плавлення. Алкени з розгалуженою будовою мають нижчі температури плавлення порівняно зі сполуками з нерозгалуженою будовою молекул. Це загальне правило для всіх органічних сполук пояснюють тим, що сполуки нормальної будови мають щільну упаковку кристала. Щоб його зруйнувати (розплавити), потрібно затратити більшу енергію, отже, й температура плавлення має бути вищою:
Етен (етилен) – безбарвний газ, майже без запаху, трохи легший за повітря, мало розчинний у воді, добре розчиняється в естері, спирті, має слабку наркотичну дію.
