
- •Лекція № 8 вуглеводні
- •Класифікація вуглеводнів
- •Коротка характеристика групи вуглеводнів
- •1. Алкани або насичені вуглеводні
- •Міжнародна номенклатура алканів або насичених вуглеводнів
- •Властивості алканів Фізичні властивості
- •Хімічні властивості
- •Добування алканів
- •Застосування алканів
- •2. Циклоалкани.
- •3. Ненасичені вуглеводні
- •3.1.Алкени або етиленові вуглеводні
- •Властивості алкенів або етиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування алкенів або етиленових вуглеводнів
- •Застосування алкенів або етиленових вуглеводнів
- •3.2. Алкіни (алкини) або ацетиленові вуглеводні
- •Властивості алкінів або ацетиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Дигалогенопохідне алкану
- •Добування алкінів або ацетиленових вуглеводнів
- •Застосування алкінів або ацетиленових вуглеводнів
- •3.3. Алкадієни або дієнові вуглеводні.
- •4. Арени або ароматичні вуглеводні
- •Властивості аренів або ароматичних вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування та застосування аренів або ароматичних вуглеводнів
- •Взаємоперетворення вуглеводнів
Властивості алканів Фізичні властивості
Найбільшими джерелами алканів у природі є природний газ і нафта. У природному газі масова частка метану сягає 98%, решта етан, пропан, бутан та інші вуглеводні. Як основа природного газу метан утворився в надрах Землі, ймовірно, внаслідок взаємодії розпечених карбідів металів з водяною парою. У природі можна спостерігати утворення метану внаслідок гниття рослинних решток без доступу повітря:
(С6Н10О5)n + nH2O → 3nCO2 + 3nCH4↑
Клітковина
На болотах метан виділяється у вигляді бульбашок на поверхні води (болотний газ). У вугільних шахтах є рудниковий газ – це теж метан. Він утворюється при розкладі залишків рослин і тварин бактеріями без доступу повітря. Метан становить основу атмосфери Юпітера та Сатурна. У нафті
виявлено вуглеводні починаючи з пентану. Тверді вуглеводні трапляються в покладах озокериту.
Перші чотири сполуки гомологічного ряду алканів (С1 – С4) за звичайних умов – гази, не мають запаху; наступні одинадцять (С5 –С15) – рідини, з характерним «бензиновим» запахом, а решта ( від С16 і т.д.) – тверді речовини без запаху. Алкани не розчинні у воді, але розчиняються в органічних розчинниках (один в одному), легші за воду.
Хімічні властивості
Хімічні властивості алканів пояснюються їх будовою. Усі валентності атомів Карбону сполучені з атомами Гідрогену та іншими хімічними елементами σ–зв’язком або одинарним зв’язком, тобто є насичені. Такий зв’язок надзвичайно міцний і низькополярний, а для його розриву необхідна велика кількість енергії. Тому алкани вступають в реакції заміщення, а не приєднання.
Саме хімічною стійкістю алканів пояснюють іншу їх назву – парафіни (від лат. parum – мало і affinis – суміжний, причетний). За кімнатної температури алкани (насичені вуглеводні) не взаємодіють з кислотами, лугами, окисниками, активними металами.
Для алканів характерні реакції горіння (повне або часткове окиснення), термічного розкладу, заміщення, ізомеризації.
1. Горіння або повне окиснення: при повному згоранні будь-якого алкану утворюються Карбон(IV)оксид (вуглекислий газ) і вода:
АЛКАН + О2 → СО2↑ + Н2О |
СН4 + 2О2 → СО2↑ + Н2О
УВАГА! СУМІШ ГАЗОПОДІБНИХ АКАНІВ З КИСНЕМ АБО ПОВІТРЯМ Є ВИБУХОНЕБЕЗПЕЧНИМИ!
2. Часткове окиснення алканів киснем може відбуватися за наявності каталізатора та температури 150 – 2000С. Продуктами окиснення є суміш оксигеновмісних органічних сполук: карбонові кислоти, спирти, альдегіди, кетони. Ці реакції використовують у промисловості.
3. Розклад алканів: при нагріванні будь-якого алкану до високої температури відбувається реакція розкладу на вуглець і водень з розривом зв’язків С – Н і С – С при температурі близько 4500С:
АЛКАН
|
С2Н6 2С + 3Н2↑
3
Особливості розкладу МЕТАНУ:
Енергія
зв’язків
С – Н більша, ніж С – С, тому метан, у
якого є лише С – Н-зв’язки,
найбільш стійкий до нагріванння серед
алканів. Температура розщеплення метану
понад 10000С.
При частковому розкладанні метану
утворюються газ ацетилен
та
водень
: 2СН4
 С2Н2
+ 3Н2↑
С2Н2
+ 3Н2↑
Ацетилен
або етин
3. Заміщення: при взаємодії будь –якого алкану з галогенами (позначається Hal і відповідає F2, CI2, Br2, J2) атоми Гідрогену поступово заміщуються на атоми Галогену ( з йодом реакції не відбуваються) з утворенням сполук, які називають галогенопохідними алканів або насичених вуглеводнів та виділенням відповідного галогеноводню (позначається Нhal і відповідає НF, НCI, НBr, НJ). Реакції відбуваються при температурі 250 – 4000С або під дією ультрафіолетового випромінювання (hν):
АЛКАН
+ Hal
|
1-стадія СН4 + СІ2 СН3СІ + НСІ
Метан Хлорометан
2-стадія СН3СІ + СІ2 СН2СІ2+ НСІ
Хлорометан Дихлорометан
3-стадія СН2СІ2 + СІ2 СНСІ3+ НСІ
Дихлорометан Трихлорометан
4-стадія СНСІ3 + СІ2 ССІ4+ НСІ
Трихлорометан Тетрахлорометан
Реакції заміщення відбуваються за вільно-радикальним механізмом.
4. Ізомеризація: Алкани нерозгалуженої будови (нормальної будови), які містять не менше чотирьох атомів Карбону, під впливом каталізаторів і нагрівання ізомеризуються й перетворюються на вуглеводні з розгалуженим карбоновим ланцюгом
СН3
– СН2
– СН2
– СН3
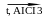 СН3
– СН – СН3
СН3
– СН – СН3
|
СН3
н-бутан ізобутан ( 2-метилпропан )
ЗАПАМ’ЯТАЙТЕ! В реакції приєднання алкани не вступають.
5. Якісна реакція на алкани: оскільки алкани не вступають в реакції приєднання (причина – наявність міцного σ – зв’язку), то реактивами для їх виявлення серед органічних сполук є Калій перманганат (KMnO4) або бромна вода (Br2)
Якщо до алкану додати слаборожевий розчин Калій перманганату (KMnO4), то забарвлення не зникає, тому що не відбувається реакція приєднання Оксигену:
АЛКАН + KMnO4 → рожеве забарвлення не зникає |
4
Якщо до алкану додати жовтуватого розчину бромної води (Br2), то забарвлення не зникає, тому що не відбувається реакція приєднання Брому:
-
АЛКАН + Br2 → жовтувате забарвлення не зникає

 ВУГЛЕЦЬ + Н2↑
ВУГЛЕЦЬ + Н2↑ ГАЛОГЕНОПОХІДНЕ АЛКАНУ + Нhal
ГАЛОГЕНОПОХІДНЕ АЛКАНУ + Нhal