
- •Лекція № 8 вуглеводні
- •Класифікація вуглеводнів
- •Коротка характеристика групи вуглеводнів
- •1. Алкани або насичені вуглеводні
- •Міжнародна номенклатура алканів або насичених вуглеводнів
- •Властивості алканів Фізичні властивості
- •Хімічні властивості
- •Добування алканів
- •Застосування алканів
- •2. Циклоалкани.
- •3. Ненасичені вуглеводні
- •3.1.Алкени або етиленові вуглеводні
- •Властивості алкенів або етиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування алкенів або етиленових вуглеводнів
- •Застосування алкенів або етиленових вуглеводнів
- •3.2. Алкіни (алкини) або ацетиленові вуглеводні
- •Властивості алкінів або ацетиленових вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Дигалогенопохідне алкану
- •Добування алкінів або ацетиленових вуглеводнів
- •Застосування алкінів або ацетиленових вуглеводнів
- •3.3. Алкадієни або дієнові вуглеводні.
- •4. Арени або ароматичні вуглеводні
- •Властивості аренів або ароматичних вуглеводнів Фізичні властивості
- •Хімічні властивості
- •Добування та застосування аренів або ароматичних вуглеводнів
- •Взаємоперетворення вуглеводнів
Властивості аренів або ароматичних вуглеводнів Фізичні властивості
Бензен (бензол) безбарвна, летка, вогненебезпечна рідина з характерним запахом. Бензен має температуру кипіння 80°С, а плавиться при 5,50С. Він не розчиняється у
воді, але добре розчиняється в органічних розчинниках і сам є розчинником для багатьох речовин. Бензен отруйний, систематичне вдихання його пари викликає анемію і лейкемію. Інші ароматичні вуглеводні, наприклад, толуен (С7Н8), менш небезпечні. При кімнатній температурі бензен інертний, а при високих температурах або за наявності каталізаторів – досить активний.
Бензен вступає в реакції заміщення:
Хімічні властивості
За рахунок ароматичного зв’язку для аренів характерні реакції приєднання ( за місцем π-зв’язків) та реакції заміщення (за місцем σ-зв'язків).
1. Повне окиснення (горіння) відбувається з кіптявою за рахунок малої кількості атомів Гідрогену:
С6Н6 + 7,5О2 → 6СО2 ↑ + 6Н2О + Q
2. Часткове окиснення. Бензойне кільце стійке до дії окисників, тому розчин KMnO4 забарвлення не змінює.
3. Заміщення:
а) з галогенами
 або
або
С6Н6 + Cl2 → С6H5Cl + НCl
Бензен Хлоробензен
б) з нітратною кислотою
 або
або
С6Н6 + HO - NO2 → С6H5 - NO2 + Н2O
Бензен Нітробензен
4. Приєднання:
а) водню
 або
або
С6Н6 + 3Н2 → С6H12
Бензен Циклогексан
16
б) галогенів
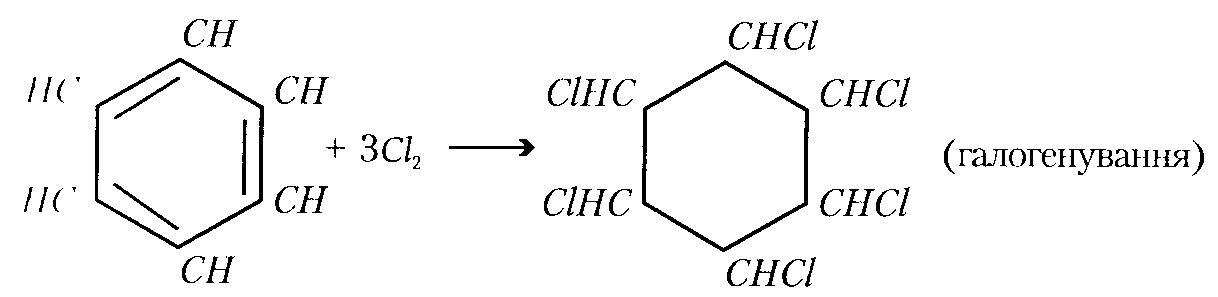 або
або
С6Н6 + Cl2 → С6H12Cl6
Бензен Гексациклогексан
5. Для гомологів бензену характерні ті самі реакції, що і для самого бензену. Водночас, вони мають і свої особливості. Так, толуен, на відміну від бензену, активніше вступає в реакцію нітрування з утворенням 2,4,6-тринітротолуену - вибухової речовини, відомої під назвою тротилу:
 або
або
С7Н8 + 3HO - NO2 → С6H3 – (NO2)3 + 3Н2O
Толуен (толуол) Тринітрололуен (тринітротолуол) – тротил
6. ЯКІСНА РЕАКЦІЯ НА АРЕНИ (АРОМАТИЧНИЙ ЗВ’ЯЗОК)
Для того, щоб визначити арени серед інших органічних сполук використовують такі реакції:
а) реакція НАСТЮКОВА – формалітова реакція. На скляну пластинку вміщують 1 – 2 краплі формаліну (40% й розчин метаналю), три краплі сульфатної кислоти та одну краплю бензену (бензолу) або його гомологу. У утворюється червоний осад.
б) реакція на БЕНЗЕН. При дії нітратної кислоти на бензен утворюється нітробензен. Коли до реакційної суміші додати води, утворюється масляниста рідина їз запахом гіркого мигдалю – НІТРОБЕНЗЕН:


Добування та застосування аренів або ароматичних вуглеводнів
Бензен добувають з нафти, кам’яновугільної смоли та кам’яного вугілля, тримеризацією етину (ацетилену):
 або
або
3С2Н2 → С6Н6
17
Бензен використовується як розчинник, а також як сировина для виробництва нітробензолу, аніліну, гексахлорану, хлорбензену, фенолу, ліків, пластмас, барвників, отрутохімікатів та багатьох інших органічних речовин. Бензеп як добавка поліпшує
якість моторного палива.
