
- •Основные теоретические сведения
- •1. Общие сведения, классификация и номенклатура спиртов
- •2. Химические свойства
- •Реакции, протекающие с разрывом связи кислород-водород
- •Реакции гидроксильной группы, протекающие с разрывом связи углерод-кислород
- •Реакции окисления
- •Дегидрирование спиртов
- •3. Многоатомные спирты
- •Лабораторная работа «спирты и эфиры» Правила по технике безопасности
- •Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
Дегидрирование спиртов
При пропускании паров спирта над катализатором дегидрирования (раскаленная медь, железо, никель) при t=250 °C первичные и вторичные спирты отщепляют по два атома водорода. При этом первичные спирты превращаются в альдегиды, а вторичные спирты в кетоны.
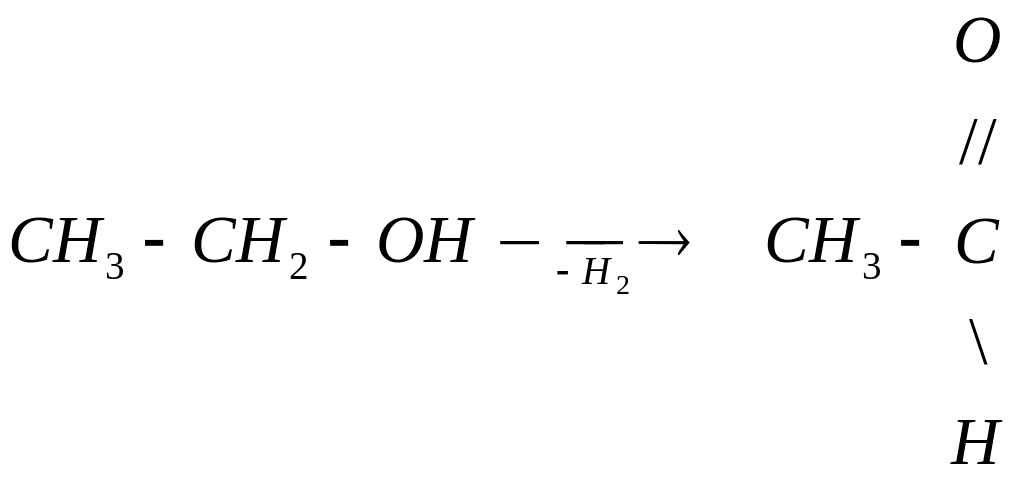
этиловый спирт уксусный альдегид
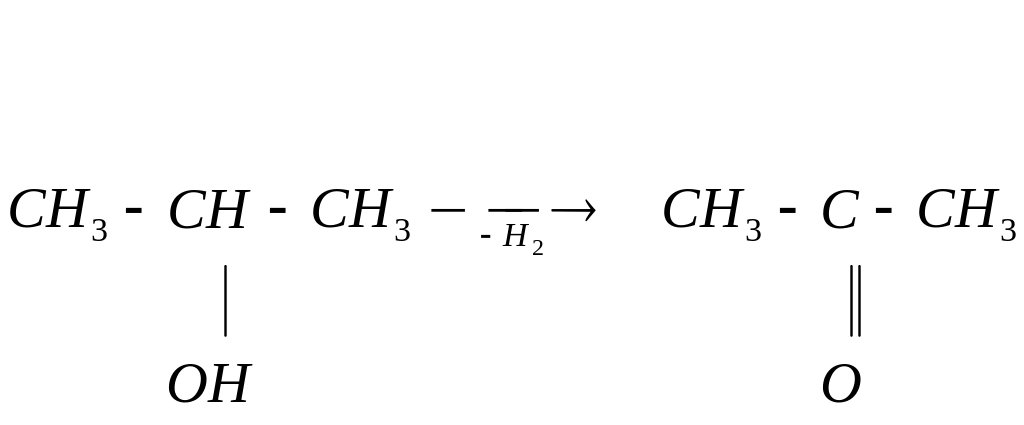
изопропиловый спирт ацетон
3. Многоатомные спирты
Двухатомные и трех атомные спирты в отличие от одноатомных легко вступают в реакции не только со щелочными металлами, но и с гидроксидами тяжелых металлов, например:
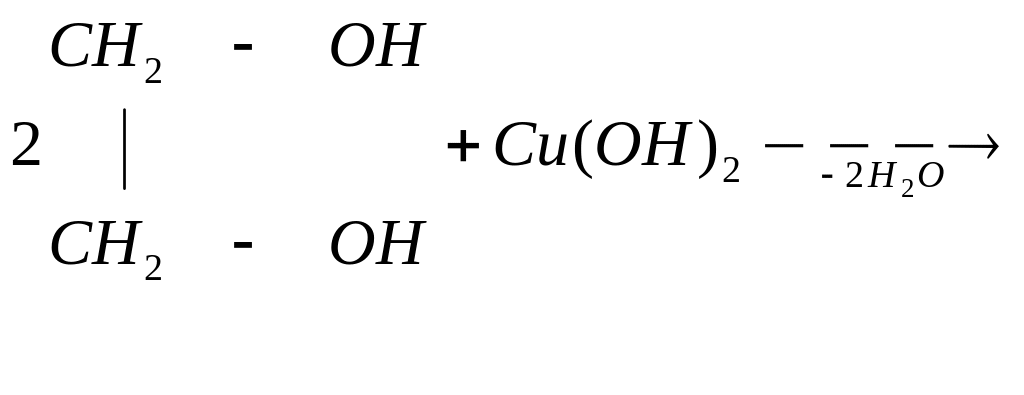
этиленгликоль
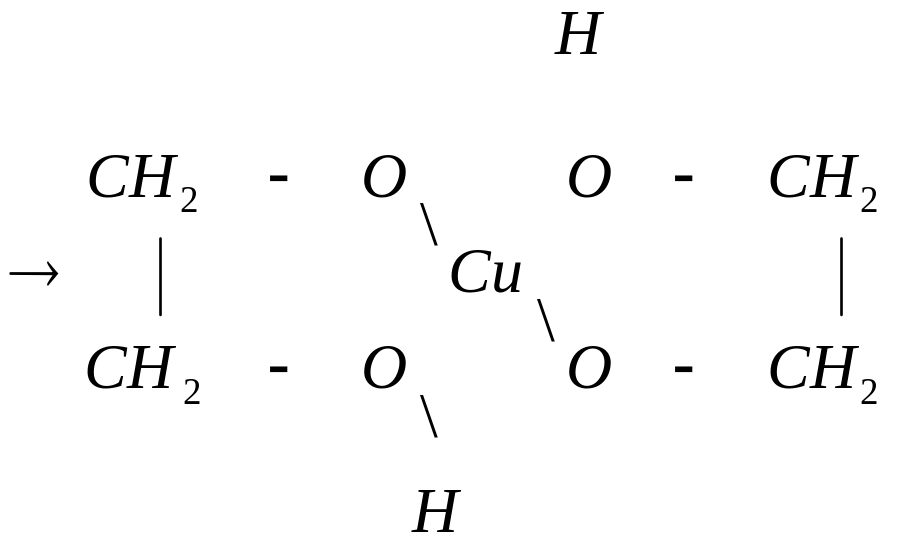




гликолят меди
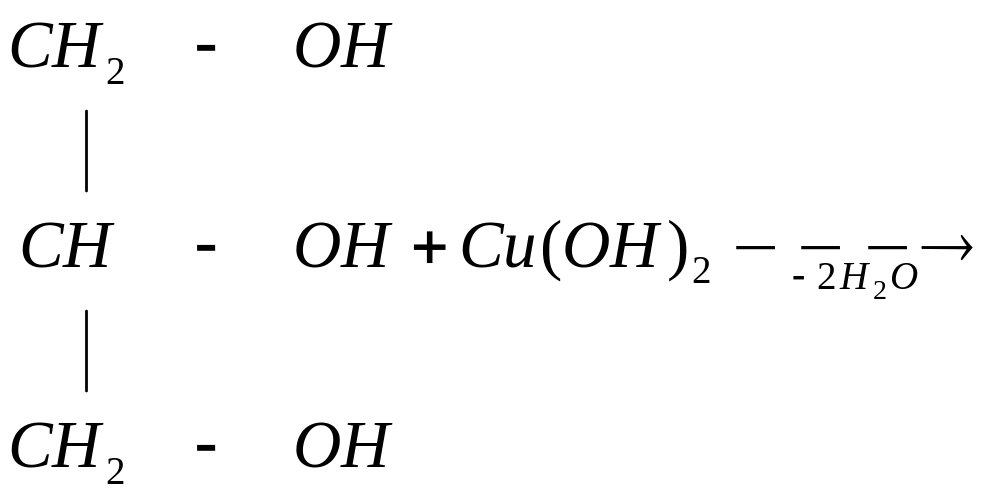
глицерин
![]()
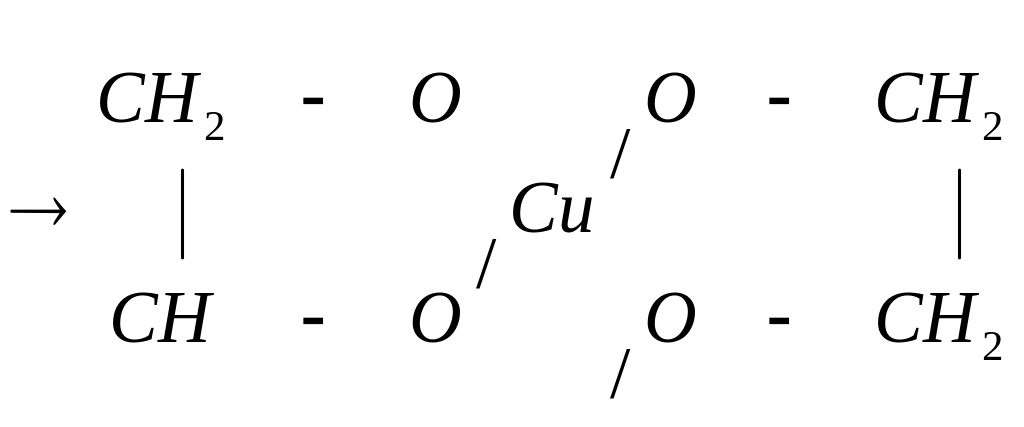
![]()


![]()
![]()
глицерат меди (комплексное соединение)
Гликолят и глицерат меди – это комплексные соединения. Комплексообразователь Cu2+ образует две обычных связи с атомом кислорода, а две – по донорно-акцепторному механизму.
Кислород является донором, а ион Cu2+ акцептором общей электронной пары. Образование соединения с гидроксидом меди – качественная реакция на многоатомные спирты.
Лабораторная работа «спирты и эфиры» Правила по технике безопасности
При работе в лаборатории органической химии необходимо строго соблюдать правила техники безопасности.
1. Органические вещества и продукты их реакций могут быть токсичны или взрывоопасны. Поэтому четко следуйте методическим указаниям при выполнении лабораторной работы.
2. Будьте осторожны при обращении с металлическим натрием, с растворами кислот и щелочей. Избегайте попадания этих веществ в глаза и на кожу.
3. Нагревание пробирок проводите в вытяжном шкафу, держите открытое отверстие пробирки от себя, слегка наклонив к стене. Особенно осторожно и аккуратно нагревайте смесь концентрированной H2SO4 и этилового спирта в опыте №4.
Экспериментальная часть
Опыт № 1 Обнаружение воды в спирте
В фарфоровой чашке нагрейте на пламени горелки 1.5 - 2 грамма CuSO4*5H2O, перемешивая соль медной проволокой до полного исчезновения голубой окраски.
Пересыпьте соль в сухую пробирку и налейте 2-3 мл этилового спирта. При встряхивании и слабом нагревании содержимого пробирки белый порошок быстро окрашивается в голубой цвет. Получившийся обезвоженный спирт используйте для следующего опыта.
Опыт № 2 Образование и гидролиз алкоголята
Полученный в опыте №1 обезвоженный этиловый спирт слейте с осадка в сухую пробирку и погрузите в него кусочек натрия. Охлаждая пробирку в стакане с водой, предотвращаем разогрев смеси и выкипание спирта. Когда газ станет выделяться спокойно, поднесите к отверстию пробирки зажженную спичку. Водород вспыхивает с резким звуком. Жидкость постепенно густеет.
Полученный концентрированный раствор алкоголята подогрейте до разжижения и с помощью изогнутой проволоки удалите из пробирки кусочек натрия.
К концентрированному раствору алкоголята добавьте 5-6 мл воды и испытайте реакцию полученного раствора фенолфталеином.
Опыт № 3 Окисление этанола
В пробирку поместите 1 мл этилового спирта, столько же 5% раствора K2Cr2O7 и 0,5 мл 10% раствора H2SO4 . Полученный оранжевый раствор слегка нагрейте над пламенем горелки до начала изменения цвета. Через насколько секунд появится зеленоватая окраска, характерная для солей Cr(III), одновременно ощущается запах уксусного альдегида (запах прелых яблок).
Опыт № 4 Образование диэтилового эфира
Смешайте в пробирке 1мл этилового спирта и 1мл концентрированной серной кислоты. Сильно разогревшуюся смесь осторожно нагрейте на горелке до начала кипения. При этом не обнаруживается запаха эфира. Удалите нагретую пробирку от горелки, очень осторожно прилейте к смеси еще пять капель спирта. При этом, сразу же появляется запах эфира.
Опыт № 5 Образование глицерата меди
В пробирку налейте 1 мл 2% раствора CuSO4 и 2 мл 10% раствора NaOH. Образуется голубой студенистый осадок Cu(OH)2 . Добавьте 1 мл глицерина и встряхните пробирку. Осадок Cu(OH)2 переходит в раствор интенсивно-синего цвета.
Напишите для каждого опыта уравнение протекающих реакций.
