
- •Основные теоретические сведения
- •1. Общие сведения, классификация и номенклатура спиртов
- •2. Химические свойства
- •Реакции, протекающие с разрывом связи кислород-водород
- •Реакции гидроксильной группы, протекающие с разрывом связи углерод-кислород
- •Реакции окисления
- •Дегидрирование спиртов
- •3. Многоатомные спирты
- •Лабораторная работа «спирты и эфиры» Правила по технике безопасности
- •Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
Реакции гидроксильной группы, протекающие с разрывом связи углерод-кислород
1) Замещение гидроксила на галоген с образованием галогенопроизводных. Происходит при взаимодействии спиртов с реактивами, содержащими галоген, например, PCl5, PCl3, SOCl2:
С2Н5ОН + SOCl2 →C2H5Cl + HCl + SO2
этанол тионилхлорид хлорэтан
Эта реакция протекает по SN механизму (реакция нуклеофильного замещения). Атакующий реагент предоставляет свою электронную пару на образовании связи.
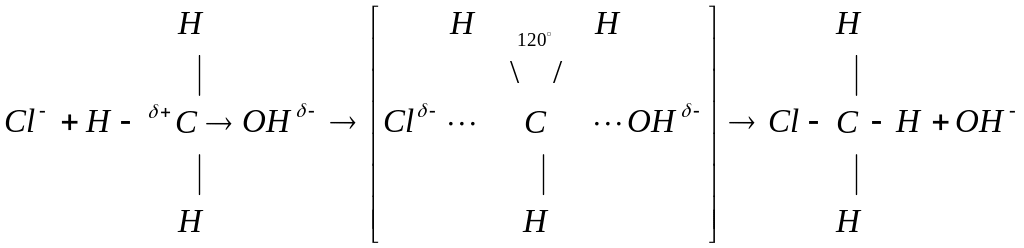
Переходное состояние
(активированный комплекс)
В переходном состоянии углерод и три атома водорода находятся в одной плоскости, перпендикулярно линии связи НО—С—Cl. Валентный угол между связями в радикале СН3 равен 120. Атом углерода находится в состоянии sp2-гибридизации атомных орбиталей. Затем гидроксильная группа удаляется, а атом хлора соединяется с СH3-радикалом. Атом углерода переходит в состояние sp3-гибридизации атомных орбиталей.
2) Дегидратация спиртов (отщепление воды)
а) Внутримолекулярная дегидратация приводит к образованию этиленовых углеводородов, её проводят в присутствии водоотнимающих средств (Н2SO4, Н3PO4, силикагель). Водород (в соответствии с правилом Зайцева) отщепляется от наименее гидрогенизированного атома углерода:
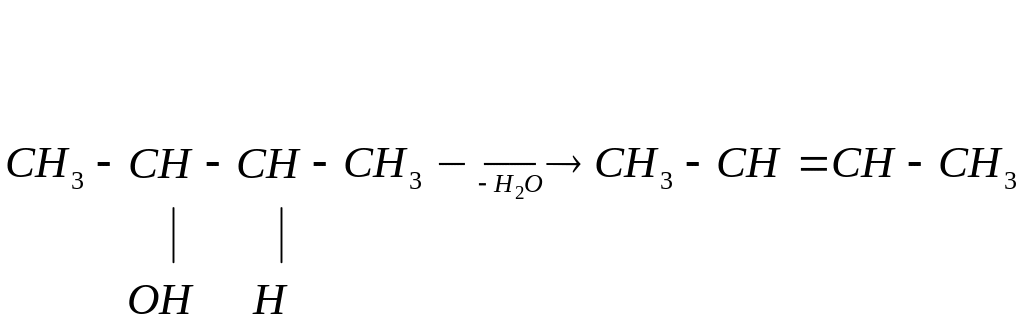
бутанол-2 бутен-2
Правило Зайцева: в реакциях дегидратации и дегидрогалогенирования водород отщепляется от наименее гидрогенизированного атома углерода соседнего с углеродом, содержащим галоген или гидроксил.
Такое отщепление водорода связано с тем, что энергия разрыва связи С—Н для третичного углеродного атома 370 кДж/моль, для вторичного 390 кДж/моль, для первичного 420 кДж/моль. Легче всего происходит дегидратация третичных спиртов, затем вторичных.
б) Межмолекулярная дегидратация.
Происходит отщепление воды от двух молекул спирта, при этом образуются простые эфиры. Реакция протекает в присутствии водоотнимающих средств в качестве катализаторов, например, концентрированной H2SO4:
СН3—СН2—ОН
+ НО—СН2—СН3![]() СН3—СН2—О—СН2—СН3
+ Н2О
СН3—СН2—О—СН2—СН3
+ Н2О
этиловый спирт диэтиловый эфир
Реакции окисления
При окислении первичных спиртов образуется альдегиды, вторичных спиртов - кетоны. Окислители: KMnO4 в кислой среде или хромовая смесь.
Альдегиды подвергаются дальнейшему окислению с образованием карбоновых кислот.
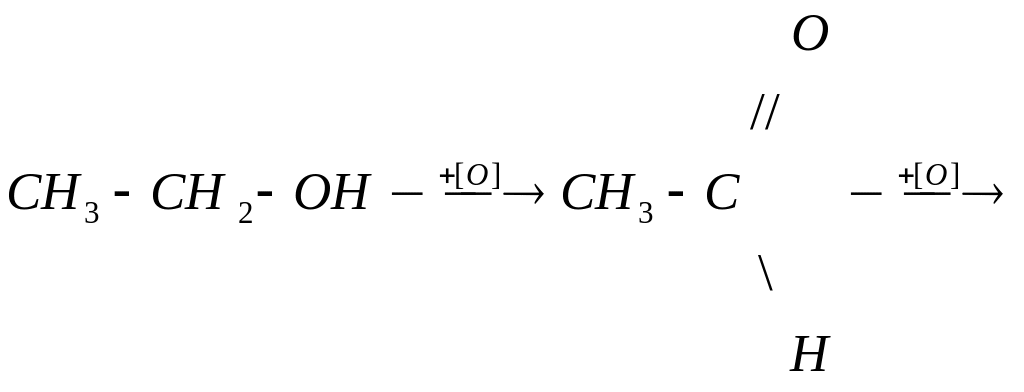
этиловый спирт уксусный альдегид
![]()
уксусная кислота
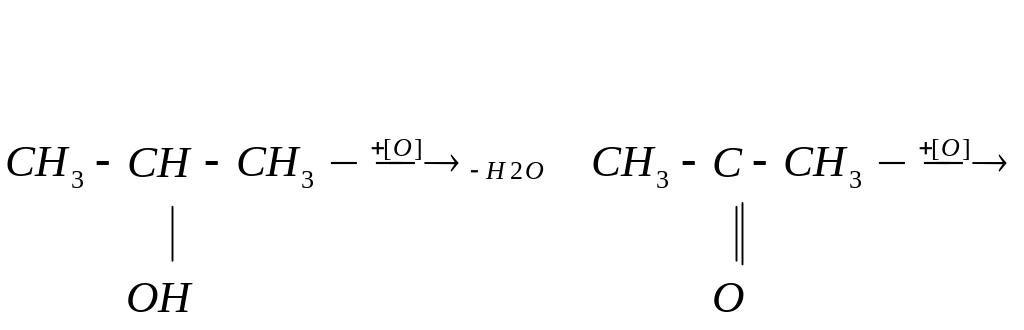
изопропиловый ацетон
спирт (вторичный)
![]()
уксусная кислота муравьиная кислота
Окисление кетонов сопровождается разрывом цепи. Третичные спирты наиболее стойки к действию окислителей. Это объясняется тем, что углеродный атом третичного спирта не содержит атомов водорода и окисление такого спирта при действии энергичных окислителей и высокой температуре приводит к разрушению молекулы с образованием смеси карбоновых кислот.
При окислении первичных спиртов образуются альдегиды, вторичных – кетоны, третичных – смесь карбоновых кислот. Образование различных продуктов при окислении первичных, вторичных и третичных спиртов дает возможность использовать эту реакцию для установления строения спирта.
