
- •Основные теоретические сведения
- •1. Общие сведения, классификация и номенклатура спиртов
- •2. Химические свойства
- •Реакции, протекающие с разрывом связи кислород-водород
- •Реакции гидроксильной группы, протекающие с разрывом связи углерод-кислород
- •Реакции окисления
- •Дегидрирование спиртов
- •3. Многоатомные спирты
- •Лабораторная работа «спирты и эфиры» Правила по технике безопасности
- •Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
Реакции, протекающие с разрывом связи кислород-водород
Спирты – очень слабые кислоты. Кислород (относительная электроотрицательность 3,5) оттягивает на себя общую электронную плотность с водородом (относительная электроотрицательность 2,1), вызывая поляризацию связи Oδ-←Hδ+. Поэтому возможно замещение атома водорода в спирте на металлы и радикалы:
1) Замещение водорода на металл (Na, K) с образованием алкоголятов - твердых веществ белого цвета.
2СН3—СН2—ОН + 2Na→2СН3— СН2—ОNa + H2
этиловый спирт этилат натрия
Строение углеводородного радикала существенно влияет на подвижность атома водорода в гидроксильной группе. Легче всего замещается водород в метаноле, трудней всего в третичных спиртах.
Сила спиртов определяется подвижностью атома водорода, его способностью замещаться на металл, его «кислотными свойствами», она в ряду уменьшается.
СН3
C H3OH > СН3 —СН2—OH > СН3 —СН—СН3 > CН3 —С—ОН
OH СН3
Расположим углеводородные радикалы по мере убывания их элктронодонорного* воздействия в ряд:
CH3
CН3 —С— СН3 —СН— СН3 —СН2— —СН3
CH3 CH3
Максимальным электронодонорным воздействием обладает радикал третичный бутил, а минимальным – метил.
CH3
↓
CH3→ C →O—H
↑
CH3
третбутиловый спирт
Смещая электронную плотность в сторону атома кислорода, (явление смещения электронной плотности по системе σ-связей в сторону более электроотрицательного элемента называется индуктивным эффектом) третичный бутил уменьшает, таким образом, поляризацию связи Oδ-←Hδ+. Уменьшается подвижность атома водорода, его способность к замещению и уменьшается сила спирта.
Если Кдисс воды составляет 10-14 (при 25 °С ), для метилового спирта Кдисс ~10-17, для этилового Кдисс ~10-18. Спирты по сравнению с водой обладают меньшей кислотностью, и она убывает от метилового спирта к этиловому.
Если ввести в радикал третичный бутил электроноакцепторные** группы или атомы, то кислотные свойства спирта (сила спирта) значительно усиливаются:
CF3
↑
Например, спирт F3C←C←O←H,
↓
CF3
за счет элетроноакцепторного действия фтора обладает более сильными кислотными свойствами и способен вытеснить угольную кислоту из её солей. В этом случае наблюдается отрицательный индуктивный эффект со стороны фтора, приводящий к подвижности водорода Hδ+.
2) Взаимодействие спиртов с магнийорганическими соединениями (реакция Чугаева, Цереветинова). При этом образуются углеводород и производные спиртов - алкоголяты:
С2Н5ОН + СН3—MgI→СН4 ↑ + С2Н5—О—Mg—I
этиловый метилмагниййодид метан этоксимагниййодид
спирт
Реакция используется для количественного определения спирта по объему выделившегося метана.
_____________________________________
* электродонорные (отдающие электроны)
**электроакцепторные (принимающие электроны)
3) Образование простых эфиров
Взаимодействие алкоголятов с галогеналкилами.
С2Н5—О—Na
+ I—С2Н5![]() С2Н5—О—
С2Н5
С2Н5—О—
С2Н5
этилат натрия йодистый этил диэтиловый эфир
Эта реакция не является химическим свойством спирта, но на ее примере можно видеть способность к замещению водорода в спирте на углеводородный радикал, с образованием простого эфира.
4) Образование сложных эфиров (реакция этерификации)
Сложные эфиры
можно рассматривать как продукты
замещения водородного атома в гидроксильной
группе на остаток карбоновой кислоты
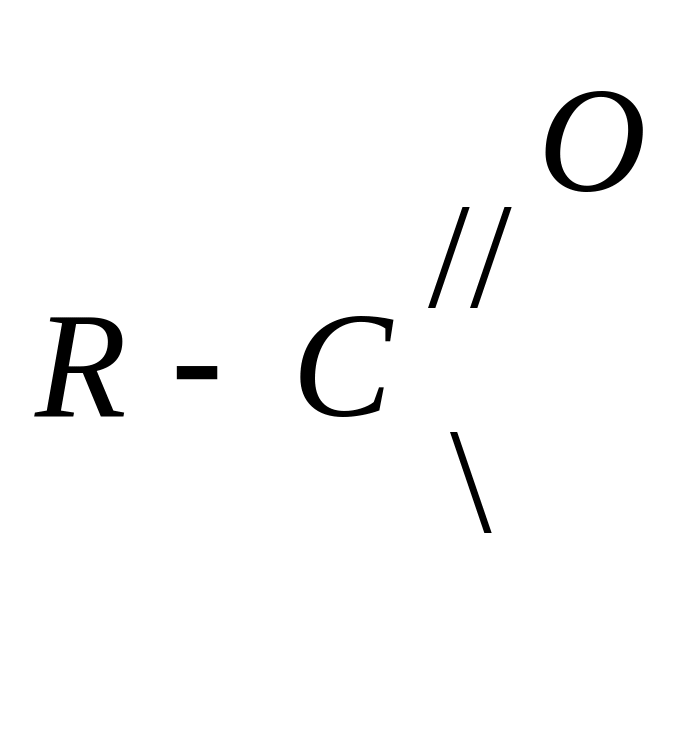 ,
который называется ацил , для муравьиной
кислоты
,
который называется ацил , для муравьиной
кислоты
![]() - формил, для уксусной
- формил, для уксусной
![]() - ацетил, для пропионовой
- ацетил, для пропионовой
![]() - пропионил.
- пропионил.
![]()
уксусная кислота этиловый спирт уксусноэтиловый эфир
(этилацетат)
Важно запомнить, что выделяющаяся при этерификации молекула воды образуется из гидроксила кислоты и водорода спирта, а не наоборот. Это было установлено методом "меченых атомов": в молекулу спирта был введен изотоп кислорода 18О, который затем был обнаружен в молекуле сложного эфира.
