
Обмен белков и аминокислот.
Белки являются источником N2 для организма, поступающий с белками азот выводится в виде конечных продуктов азотистого обмена, который характеризуется понятием азотистый баланс.
Азотистый баланс – разница между поступающими в организм N2 и выводимым из организма.
Различают три вида:
Азотистое равновесие
Положительный азотистый баланс
Отрицательный азотистый баланс
При положительном азотистом балансе поступление N2 преобладает над выделением. Различают «+» азотистый баланс (беременность). Для детей 1 года жизни - +30%, в 4 года - +25%, в подростковом (14 лет) +14%. Ложный «+» азотистый баланс, при котором происходит задержка в организме конечных продуктов азотистого обмена. Это наблюдается при заболевании почек.
«-» азотистый баланс – преобладает выделение над поступлением. Это при тяжелых заболеваниях, туберкулез, ревматизм, онкологических заболеваний.
Азотистое равновесие – поступление N2=его выделению. Характерно для здоровых взрослых людей.
Азотистый обмен характеризуется коэффициентом изнашивания – то количество белка, которое теряется из организма в условиях полного белкового голодания. Для взрослого – 53 мг/1 кг, 24 г/сут. У новорожденных коэффициент изнашивание выше и составляет 120мг/кг. Азотистое равновесие обеспечивается белковым питанием. Этот белковый рацион должен иметь определенное количество и начальными характеристиками.
Количественный критерий:
Для взрослых существует 2 нормы:
Белковый минимум – то количество белка, которое обеспечивает азотистое равновесие при условии, что все энергетические затраты обеспечиваются углеводами и жирами. 40-45 г/сут.
Белковый оптимум – если долго использовать белковый минимум, то постепенно при ограниченном доступе страдают иммунные процессы, процессы кроветворения, репродуктивная система, поэтому оптимально для взрослых является более высокая норма – оптимум (оно обеспечивает выполнение всех его функций без ущерба для здоровья). 100 – 120 г/сут.
Для детей: В настоящее время норма потребления пересматривается в сторону их снижения. Для новорожденного ≈ 2 г/кг, к концу 1 года до 1 г/сут (при естественном вскармливании). 1,5 – 2 г/сут (при искусственном вскармливании.
Качественный критерий:
Все белки делятся на полноценные и неполноценные. Полноценные белки должны отвечать следующим требованиям:
Содержать набор всех незаменимых аминокислот (валин, лейцин, изолейцин, тропин, метионин, лизин, аргенин, гистидин, триптофан, фенилаланин).
Соотношение между аминокислотами должно быть близким к соотношению в тканевых белках
Хорошо перевариваться в ЖКТ
Полноценные жиры – животные. Для новорожденных все белки должны быть полноценными (белки грудного молока). В возрасте 3-4 года ≈ 70-75% должны быть полноценными. Для взрослых ≈ 50%.
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Протеолитические ферменты выделяются в неактивном состоянии (защитный механизм от переваривания тканевых белков)
Их активирование происходит в просвете ЖКТ путем частичного протеолиза
Протеазы ЖКТ могут относится либо к эндопептидам или экзопептидазам (концевые аминокислоты отрываются) они отличаются субстратной специфичностью.
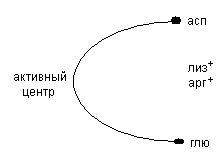
Переваривание белков происходит в желудке и в тонком кишечнике. Основной фермент расщепляющий белок является пепсин. Он выделяется в неактивном состоянии в виде профермента – пепсиногена. Под действием HCl идет частичный протеолиз и превращение его в активную форму пепсин.
![]()
Это обнажает активный центр, меняет структуру белка. Пепсин относится к эндопептидазам (разрывает внутри пептидные связи) тирозин – фенлиаланин действует после этих аминокислот.
Роль HCl:
Специфичный активатор пепсиногена
Обеспечивает оптимум рН для пепсина (рН = 1-2)
Вызывает частичную денатурацию белка
Бактерицидный барьер
Слизистая желудка имеет целый ряд защитных механизмов:
выработка слизи (основной компонент ТАГ)
выделение пепсина в неактивном состоянии
выделение бикарбонатов
У детей процессы переваривания менее активны, чем у взрослых так как менее активный пепсин, более щелочная среда в желудке у маленьких детей в желудке кроме пепсина есть хемозин (фермент створаживающий молоко), гастриксин (рН 4-5), протеазы грудного молока, катепсины. В желудке происходит частичное перевариваривание белков до пептидов. Дальнейшее переваривание в тонком кишечнике под действием ферментов поджелудочной железы и собственные ферменты.
Ферменты поджелудочной железы:
трипсин
хемотрипсин
эластаза
карбоксипептидазы
т
Хемотрипсин – вырабатывается в неактивном состоянии - хемотрипсиноген, активируется трипсином путем частичного протеолиза, относится к эндопептидазам, содержат в активном центре гидрофобной аминокислоты, расщепляет связи ароматических кислот (фен, тир)
Эластаза – активирует проэластаза, трипсином (частичный протеолиз), в активном центре эластазы преобладает ГЛИ, действует на пептидные связи.
Карбоксилазы – относятся к эндопептидазам, отщепляет концевые аминокислоты, тип А-отщепляют С-конец аминокислоты, ароматические (фен, тир) тип В – отщепления С-концевой от лизина и аргинина.
Ферменты поджелудочной железы:
аминопептидазы
дипептидазы
Аминопептидазы – эйкопептидазы, отщепляют N-конец аминокислоты среди аминопептидаз активной является лейкоаминопептидаза (ЛАГ). Дипептидазы расщепляет дипептидазы. В тонком кишечнике происходит полная гидролитическое расщепление пищевых белков до аминокислот. Образовавшиеся аминокислоты подвергаются всасыванию. У детей снижена активность ферментов слизистой кишечника и поджелудочной железы.
ВСАСЫВАНИЕ АМИНОКИСЛОТ
Na-зависимый активный процесс, нужна АТФ; перенос отдельных аминокислот осуществляется специальными переносчиками. Среди транспортных систем наиболее важной является система, предполагающая участие:
трипептидаза глютадиона (глю-гли-цис) и глю имеет свободные СООН группы
γ-глютамин-транс-пептидаза
Суть:
Аминакислота связана с глютаминовой кислотой и образует комплекс→подвергается всасыванию, глю-возвращается. Эта активно для ЦНС, сер, треонина.
У детей могут всасываться не только аминокислоты, но и пептиды и низкомолекулярными белками. Эта способность имеет 2 следствия:
могут поступать Jg, антитела из грудного молока
вызывают аллергическую реакцию
ГНИЕНИЕ БЕЛКОВ В ТОНКОМ КИШЕЧНИКЕ
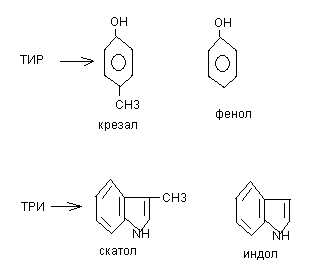
Процессу гниения подвергаются не полностью расщепляющиеся белки и отдельные аминокислоты. Оно под действием ферментов гнилостной микрофлоры. При гниении образуется большое количество газообразного и негазообразного нередко токсичные веществ. К продуктам гниения относится: CO2, CH4, NH3, H2S, меркаптаны, альдегиды, кетоны, карболовые кислоты, диамины.
Диамины образуются из аминокислот (лизин, орнитин). При их декарбоксилировании образуется:
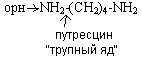
![]()
Могут выводится из кишечника или обезвреживаться в печени, могут обезвреживать токсичные циклические продукты.
Ч
ОБЕЗВРЕЖИВАНИЕ В ПЕЧЕНИ ПРОДУКТОВ ГНИЕНИЯ БЕЛКОВ
Выделяют:
синтез мочевины из NН3
м
икросомальное окисление токсичных веществ – участвуют мооксидазы, в результате гидроксилирования идет снижение токсичности, повышается водорастворимость, повышается реакционная способность.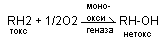
образование парных нетоксичных соединений – образующихся путем присоединения к обезвреживанию продуктами Н2SО4 в процессах обезвреживания участвует в активной форме ФАДС (фосфо-аденозил-фосо-сульфат), которая обезвреживает индоксил:
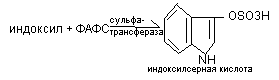
Калиевая соль этой кислоты выводится через почки. Его количество в моче свидетельствует об антитоксической функции почек и усилении гнилостных процессов.
Гиалуроновая кислота-активная форма это УДФ-глюкозовая кислота (урацил-рибоза-ф-ф-глюкуроновая кислота)
![]()
Глицин – бензойная кислота + глицерин→гиалуроновая кислота, используется для оценки антитоксической функции печени.
Проба Квина – вводят бензойную кислоту. Антипириновая проба – аптипириновое вещество, которое в печени подвергается микросомальное окисление.
Гнилостные процессы у детей отсутствуют. У взрослых усиление гнилостных процессов при снижении активности протеолитических ферментов желудка и кишечника при снижении моторики ЖКТ, дизбактериозах.
ДИНАМИЧЕСКОЕ ОСОТОЯНИЕ БЕЛКОВ В ОРГАНИЗМЕ.
Белки тканей организма постоянно обновляются, то есть подвергается распаду и постепенно замещаюися вновь синтезированными. В таких тканях как кровь, слизистая кишечника, печень приблизительно за 10 дней, Белки обмениваются на ½ - период полуобмена. В других тканях – кожа, мышцы период полуобмена >. Распад тканевых белков (катаболизм) осуществляют особые тканевые протеолитические ферменты катепсины. Выделяют несколько видов, которые обозначают: А, В, Д, Н, N. Катепсины локализованы как в лизосомах так и в цитозоле. Лизосомальные называются кислыми катепсинами так как оптимум рН= 4,5-5,5. Катепсины могут быть как эндопептидазами, так и экзопептидазами. В активном центре катепсинов могут присутствовать цистеин, аспарагиновая кислота, серин. Например катепсин Д по эффекту аналогичен катепсину желудочного сока, катепсин Н – печени, катепсин N – обладает калогенолитической активностью.
Биороль:
участвует в обновлении тканевых белков
разрушает дефективный денатуриновый белок. Обычно эти белки вначале соединяются в особый белок убиквинтин и после этого начинается разрушение дефективных белков катепсинами
реконструктивная функция – катепсины переводят неактивные формы белки в активные.
При голодании, кровопотери, интоксикации катепсины обеспечивают мобилизацию белков из условных депо белков (плазма крови, мышцы, печень).
В ткани всегда существует определенный запас аминокислот. Он поддерживается на достаточно постоянном уровне благодаря сбалансированности путей образования и использования аминокислот.
Пути образования тканевых аминокислот
Аминокислоты всосавшиеся из кишечника в результате переваривания пищевых белков (1/3 фонда)
Аминокислоты, образовавшиеся при распаде белков
Синтез в тканях заменимых кислот
Пути расходования
Синтез тканевых белков из пепетидов
образование небелковых N-содержащих веществ (пуриновые основания, креатинин, биогенные амины)
с энергитической целью
на синтез углеводов (глюконеогенез)
образование некоторых метаболитов липидного обмена
Катаболизм условно делят на: общие реакции (происходят в отношении радикала, аминогрупп, СООН-групп), специфические реакции.
Аминогруппы аминокислот.
NH2 группы обычно с аминокислоты переносятся на альфа-кето-кислоту (чаще альфа-кетоглютаровую) с образовавшейся глютаминовой кислоты отщепляется NH3, который в виде глютамина транспортируется к печени и почкам, где образуются конечные продукты азотистого обмена. Начальным процессом является трансаминирование. Это ферментативный процесс переноса NН2 группы с аминокислоты на альфа-кето кислоту при участии витиамина В6. Впервые эти процессы были изучены Браунштейном (1937). В процесс трансаминирования могут включатся все аминокислоты. В качестве альфа-кето кислоты, чаще используется ПВК, ЩУК, альфа-кетоглютаровая.
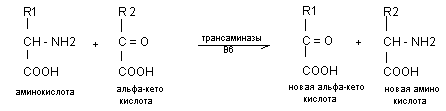
Наиболее активными трансферазами являются:
АлАТ – аланин-транс-аминаза
ГПТ – глютамино-ПВ-трансаминаза
ГЩТ – глютамино-щавелево-уксусная трансфераза
ГОТ –
Ко-ферментом является витамин В6, чаще встречается в 2-х формах:
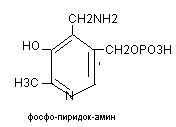
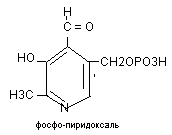
Распространение: злаки, дрожжи
Суточная потребность: ≈ 2 мг
Биороль: ко-фермент реакций трансаминирования и декарбоксилирования аминокилот
Авитаминоз: проявляется дерматитом, дегенерацией в нервной системе, демиелинизация нервных стволов
Биозначение: реакции трансаминирования велико:
Происходит потеря аминогрупп от аминокислоты без выделения токсичного NH3
Способ последующего включения безазотистого остатка аминокислот в цикл Кребса с выделением энергии
Способ синтеза новых заменимых аминокислот в тканях (ПВК – ала, ЩУК – асп к-та, альфа-кетоглютаровая – глютаминовая)
Определение активности имеет важное диагностическое значение так как в разных тканях преобладает активность определенных трансаминаз.
В сердечной мышце высока активность аспартатаминотрансферазы; в печени- аланинтрансферазы. Нередко определяют коэффициент Де Ритиса = АсАт/АлАТ = 1,33. При инфаркте миокарда этот коэффициент увеличивается, при заболеваниях печени снижается.
Дезаминирование аминокислот.
В тканях различают несколько вариантов дезаминирования: окислительное, непрямое, внутримолекулярное.
Окислительное – это ферментативный процесс отщепление NН2 от аминокислоты после предварительного окисления аминокислоты. В окислительном дезаминировании участвуют ферменты:
Альфа-амино-кислото-оксидазы – флавиновые кислоты. В качестве ко-ферментов. их роль не велика так как малоактивны в таких условиях так как оптимум рН=10
Д-амино-кислото-оксидазы – флавиновые ферменты. ФАД – коферменты, оказывают Д – амино-кислоты
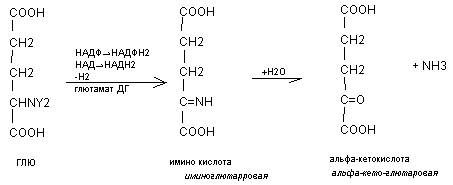
Глютамат ДГ – НАД(НАДФ) зависимых феремнтов очень активный фермент, аллостерический, олигомерный ингибитором является АТФ. Наиболее активна в процессе окислительного дезаминирования включается глютаминовая кислота.
Глицин-оксидаза
Биозначение: эта реакция позволяет аминокислотам освобождаться от
аминогруппы и переходя в альфа-кето-кислоту включатся в цикл Кребса – биосинтетические процессы.
В тканях для большинтсва аминокислот в реакции трансаминирования и окислительного дезаминирования тесно друг с другом связаны и получили название:
Непрямое – так как возможности окислительного дезаминирования очень малы, поэтому вначале большинтсво аминокислот вступает в реакцию трансаминирования с альфа-кетоглютаровой кислотой. Образуется глютаминовая кислота подвергается активно окислительному дезаминированию под действием глютамат ДГ.
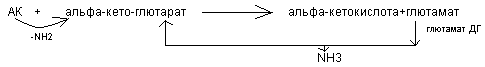
Около 1/3 аминокислот встраивается в непрямое дезаминирование.
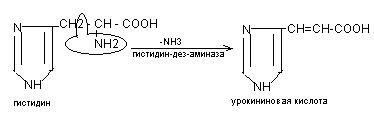
Внутримолекулярное дезаминирование. В него чаще других входит гистидин, серин, треонин, цистеин. Для гистидина – происходит выделение NН3 за счет внутримолекулярной перестройки:
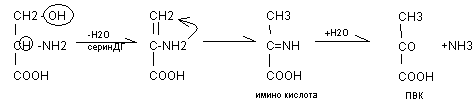
Для серина:
У детей: процессы трансаминирования и дезаминирования идут более активно, чем у взрослых. Процессы
Декарбоксилирование – ферментативный процесс отщепления СО2 из СООН групп.
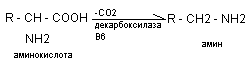
Наиболее активно в деркарбоксилировании вступает гистидин, тирозин, глю кислота, триптофан. Образующийся при декарбоксилировании амины называются биогенными аминами, как правило, обладают высокой физиологической, биохимической активностью, влияют на тонус сосудов, нейромедиаторы психических процессов. К основным биогенным аминам относится:
Гистидин:
С
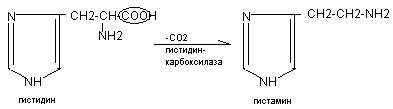
Эффекты: расширение сосудов, снижение АД, увеличивает тканевую проницаемость – отек, стимулирует желудочную секрецию, обладает бронхоспатическим эффектом. В высокой концентрации – медиатор воспалительных и аллергических реакциях.
Серотонин:
С
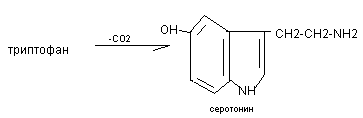
Эффекты: спазм сосудов, повышение АД, участвует в перистальтике кишечника, в реакции терморегуляции, в механизмах сна, является источником для синтеза гормона мелатонина, влияет на психические реакции человека. При нарушении обмена серотонина – шизофрения.
Катехоламины: дофамин, адреналин, норадреналин
![]()
Эффекты:
Адреналин - медиатор возбуждений, при его дефиците развивается болезнь Паркинсона (адинамия, ригидность, тремор).
Норадреналин – нейромедиатор вызывает спазм сосудов, повышают АД, стимулирует работу сердца.
ГАМК:
Э
![]()
Ацетилхолин, полиамин, спермин, спермидин: синтезируются из орнитина и метионина, входят в состав хроматина => участвует в регуляции процесса трансляции, транскрипции, репликации.
Так как биогенные амины очень активны, то распад биогенных аминов осуществляется несколькими способами: окисление, метилирование, дезаминирование и т.д. Основным способом является окислительное дезаминирование под действием ферментов аминооксидаз (моно МАО, поли ПАД). Ингибиторы МАО широко применяются для лечения.
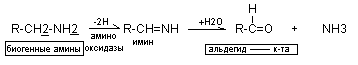
ИСТОЧНИКИ ОБРАЗОВАНИЯ АММИКА И ПУТИ ОБЕЗВРЕРИЖИВАНИЯ
А образуется в результате дезаминирования таких веществ как аминокислоты, амины, пуриновые и пиримидиновые нуклеатиды. Аммиак чрезвычайно токсичное вещество. Токсичность аммиака объясняется многими его эффектами главными среди которых будут связывание альфа-кето-кислот и блокирование включений этих альфа-кето-кислот цикл Кребса, что нарушает энергетический обмен в тканях. Кроме того может повышается концент рация глютамата до токсичных для ткани мозга концентраций. Кроме того аммиак вызывает защелачивание тканей и нарушает транспорт Na и Са. Поэтому концентрация аммиака в тканях и в крови очень низка так в плазме крови: 20-80 мкмоль/литр. Эта низкая концентрация поддерживается наличием в организме путей связывания (обезвреживания) аммиака. Эти способы можно разделить на:
временные (протекают в тканях)
в
осстановительное аминирование альфа-кето-кислот
амидирование белков
синтез глютамина
образование конечных продуктов азотистого обмена
соли аммония
мочевинамиди
Восстановление
Присоединение к альфа-кето-кислотам аммиака с одновременным восстановлением альфа-кето-кислоты с образованием аминокислоты.
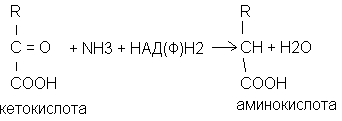
В качестве альфа-кето-кислот используется пировиноградная кислота которая восстанавливается в фенлаланин, щавелевоуксусная в аспарагиновую кислоту, альфа-кето-глютаровая кислота получается глютаминовая кислота.
Биологическое значение восстановления.
Путь быстрого связывания аммиака
Способ синтеза новых заменимых аминокислот
Амидирование тканевых белков.
Присоединение аммиака к карбоксильным группам аспарагиновой, глютаниковой аминокислот и альфа-концевым карбоксильным группам.
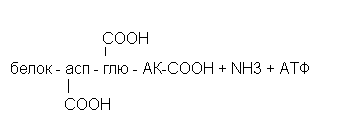
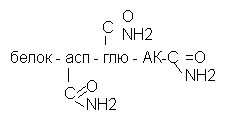
Амидирование сопровождается изменением ф-х свойств: ионизация, структура т.е. белки «портятся»
