
- •Характерные и специфические реакции катионов хрома.
- •Характерные и специфические реакции катионов цинка.
- •Характерные и специфические реакции катионов олова.
- •4. Восстановление шестизарядного молибдена солями двухзарядного олова.
- •Дробное открытие катионов четвертой аналитической группы
- •Вопросы для самостоятельной работы.
2.3.Аналитические реакции катионов четвертой, пятой и шестой аналитических групп.
2.3.1. Четвертая аналитическая группа катионов: Zn2+, Al3+, Sn2+, Cr3+.
Общеаналитические реакции катионов группы амфотерных гидроксидов
Для катионов четвертой аналитической группы характерным является то, что в щелочной среде они переходят в гидроксокомплексные соединения. Подобным свойством обладают только катионы данной группы, а также катионы свинца и в значительной степени - сурьмы. Значит, катионы свинца и сурьмы по данной классификации могут быть отнесены к данной группе. Избыток щелочи, дающий возможность отделить катионы алюминия, хрома, цинка, олова, мышьяка от катионов других групп (кроме первой), является типичным групповым реактивом на эти катионы.
Второй характерной особенностью катионов этой группы является то, что почти все их соли в той или иной степени подвергаются гидролизу. Наиболее полному гидролизу подвергаются соли олова и мышьяка. Поэтому олово и мышьяк в форме катионов могут находиться только в кислых растворах (главным образом – солянокислых). В нейтральных же растворах олово переходит в осадок соответствующих гидроксидов.
Sn2+ + 2H2O = Sn(OH)2 + 2H+
Все соли хрома, алюминия, цинка также в известной степени подвергаются гидролизу: водные растворы хлоридов солей в той или иной степени являются кислотными, а карбонаты солей этих катионов под действием воды образуют соответствующие гидроксиды или (в случае цинка) переходят в основные соли:
Al2(CO3)3 + 3H2O = 2Al(OH)3 + 3CO2↑
2ZnCO3 + H2O = (ZnOH)2CO3 + CO2↑
1. Действие эквивалентного количества щелочи натрия и калия.
Со всеми катионами четвертой аналитической группы щелочи образуют амфотерные осадки гидроксидов (все осадки белого цвета, кроме осадка Cr(OH)3):
ZnCl2 + 2NaOH = Zn(OH)2¯ + 2NaCl
SnCl2 + 2NaOH = Sn(OH)2¯ + 2NaCl
AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl
CrCl3 + 3NaOH = Cr(OH)3¯ + 3NaCl
серо-зеленый
2. Действие избытка щелочей.
Zn(OH)2¯ + 2NaOH = Na2 [Zn(OH)4] бесцветный
гексагидроксо(П) цинкат натрия
Sn(OH)2¯ + 2NaOH = Na2 [Sn(OH)4] бесцветный
гексагидроксо(П) станнат натрия
Al(OH)3¯ + 3NaOH = Na3[Al(OH)6] бесцветный
гексагидроксо(III) алюминат натрия
Cr(OH)3¯ + 3NaOH = Na3[Cr(OH)6] ярко-зеленый
гексагидроксо(III) хромат натрия
Под действием кислот гидрокомплексные соединения четвертой аналитической группы разрушаются с образованием соответствующих солей:
K3[Al(OH)6] + 6HCl = AlCl3 + 3KCl + 6H2O
K3[Cr(OH)6]+ 6HCl = CrCl3 + 3KCl + 6H2O
K2[Zn(OH)4] + 4HCl = ZnCl2 + 2KCl + 4H2O
K2[Sn(OH)4] + 4HCl = SnCl2 + 2KCl + 4H2O
3. Под действием гидроксида аммония катионы алюминия, хрома, цинка и олова тоже образуют соответствующие гидроксиды: MeCl2 + 2NH4OH = Me(OH)2¯ + 2NH4Cl, из которых гидроксид цинка Zn(OH)2 в отличие от остальных гидроксидов этой группы в избытке NH4OH легко растворяется с образованием комплексной соли аммиаката цинка:
ZnCl2 + 2NH4OH = Zn(OH)2¯ + 2NH4Cl
Zn(OH)2¯ + 4NH4OH = [Zn(NH3)4](OH)2 + 4H2O
Кислотные и основные свойства катионов амфотерных гидроксидов, изменяются в следующем порядке:
увеличение кислотных свойств

Cr3+ → Al3+→ Zn2+→ Sn2+

увеличение основных свойств
Отличительной особенностью гидроксида хрома является его свойство соосаждать и соосаждаться вместе с гидроксидами других катионов (главным образом цинка, кобальта, никеля) и полную нерастворимость в избытке гидроксидов.
Гидроксид хрома Cr(OH)3 и гидроксид цинка Zn(OH)2 отдельно друг от друга легко растворяются в разбавленной щелочи; если же катионы хрома и цинка присутвовали совместно, то полученный при действии на них щелочи калия осадок гидроксидов нерастворим даже в большом избытке щелочи.
Катионы хрома Cr3+ и катионы цинка Zn2+ не образуют осадка при действии на них ацетата натрия CH3COONa. Но, если катионы
 хрома
Cr3+
и цинка Zn2+
присутствуют в растворе совместно, то
при взаимодействии их с ацетатом натрия
из раствора выпадет осадок, который
нерастворим в избытке щелочей; аналогичное
явление наблюдается Cr3+
- Ni2+;
Cr3+
- Co2+.
хрома
Cr3+
и цинка Zn2+
присутствуют в растворе совместно, то
при взаимодействии их с ацетатом натрия
из раствора выпадет осадок, который
нерастворим в избытке щелочей; аналогичное
явление наблюдается Cr3+
- Ni2+;
Cr3+
- Co2+.
Подобное явление объясняется тем, что во всех указанных случаях хром Cr3+ осаждается не в форме гидроксида хрома Cr(OH)3, а в виде соответствующих его солей (хромита кобальта Co(CrO2)2, цинката хрома Cr2(ZnO2)3, которые в избытке щелочей не растворяются.
1. Сr2(SO4)3 + 3ZnSO4 + 12KOH = Cr2(ZnO2)3¯ + 6K2SO4 + 6H2O
2. 2CrCl3 + CoCl2 + 8KOH = Co(CrO2)2 ¯ + 8KCl + 4H2O
3. 2Al(OH)3 + 2Cr(OH)3 = Al2O3 ∙ Cr2O3 ¯ + 6H2O
4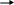
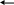 .
CH3COONa
+ H2O
CH3COOH
+ NaOH (гидролиз)
.
CH3COONa
+ H2O
CH3COOH
+ NaOH (гидролиз)
12NaOH + 3ZnCl2 + 2CrCl3 = Cr2(ZnO2)3¯ + 12NaCl + 6H2O
Такие свойства амфотерных гидроксидов и их щелочных растворов используется в химическом анализе для выделения и открытия катионов данной группы, например:
1) Если на раствор четвертой аналитической группы подействовать разбавленной щелочью, окажется, что полученный осадок в избытке щелочи не растворяется – это явление признак того, что в растворе присутствуют катионы хрома и цинка; если осадок в избытке разбавленной щелочи растворяется – один из данных катионов в растворе отсутствует. По цвету осадка или цвету раствора можно судить о присутствии катионов хрома.
2) Если на смесь катионов четвертой аналитической группы действовать избытком гидроксида аммония NH4OH, то катионы хрома, алюминия, и олова останутся в осадке, а цинк останется в растворе.
ZnCl2 + 2NH4OH = Zn(OH)2¯ + 2NH4Cl
Zn(OH)2¯ + 4NH4OH = [Zn(NH3)4](OH)2 + 4H2O
избыток
[Zn(NH3)4](OH)2 раствор комплексной соли дигидроксида тетрааминцинка (П).
3) Если на раствор, содержащий катионы четвертой группы, подействовать избытком щелочи, образовавшийся вначале осадок полностью раствориться, а при добавлении к этому раствору небольшого количества соли хрома осадок в избытке щелочи не раствориться, то это говорит о том, что в растворе есть катионы цинка; если к исследуемому раствору добавить небольшое количество цинка, если осадок нерастворим в избытке щелочи, будет указывать на наличие в растворе хрома.
4) Чтобы удалить катионы цинка из раствора смеси катионов, следует добавить эквивалентное количество соли хрома и подействовать на этот раствор избытком разбавленной щелочи: при этом весь цинк будет соосажден с гидроксидом хрома.
4. Действие карбонатов.
Карбонаты осаждают катионы алюминия, хрома и олова в виде соответствующих гидроксидов, а катионы цинка - в виде основных солей переменного состава.
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 ¯ + 6NaCl + 3CO2↑
Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3 ¯ + 3Na2SO4 + 3CO2↑
SnCl2 + Na2CO3 + H2O = Sn(OH)2 ¯ + 2NaCl + CO2↑
2ZnCl2 + 2Na2CO3 + H2O = Zn2(OH)2CO3 ¯ + 4NaCl + CO2↑
3ZnCl2 + 3Na2CO3 + H2O = Zn3(OH)2(CO3)2 ¯ + 6NaCl + CO2↑
Все осадки белого цвета, (кроме гидроксида хрома - серо-зеленого), растворимы в избытке щелочей, а основные соли карбоната цинка, кроме того, в растворе аммиака в присутствии хлорида аммония NH4Cl.
5. Действие гидрофосфат натрия Na2HPO4.
Гидрофосфат натрия Na2HPO4 осаждает катионы алюминия, хрома, цинка в виде соответствующих фосфатов, а олова в виде гидроксида олова:
3
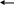 ZnCl2
+ 4Na2HPO4
Zn3(PO4)2¯
+ 2NaH2PO4
+ 6NaCl
ZnCl2
+ 4Na2HPO4
Zn3(PO4)2¯
+ 2NaH2PO4
+ 6NaCl
CrCl3 + 2Na2HPO4 = CrPO4¯ + NaH2PO4 + 3NaCl
AlCl3 + 2Na2HPO4 = AlPO4¯ + NaH2PO4 + 3NaCl
3SnCl2 + 4Na2HPO4 = Sn3(PO4)2¯ + 2NaH2PO4 + 6NaCl
И далее полный гидролиз:
S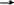
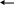 n3(PO4)2¯
+ 6H2O
3Sn(OH)2
¯
+ 2H3PO4
n3(PO4)2¯
+ 6H2O
3Sn(OH)2
¯
+ 2H3PO4
Все осадки хорошо растворяются в минеральных кислотах и щелочах, а фосфаты алюминия и хрома растворяются в уксусной кислоте CH3COOH. Осаждение цинка фосфатом неполное, т. к. реакция обратима. Если же к нейтральному или слабокислому раствору соли цинка прибавить гидрофосфат натрия Na2HPO4 и небольшое количество NH4OH, чтобы рН раствора был равен 5,6 – 6,6 (в присутствии индикатора метилового оранжевого), то цинк выделяется полностью в виде белого кристаллического осадка ZnHPO4. Данная общеаналитическая реакция может использоваться для открытия катиона из смеси четвертой аналитической группы катионов.
6. Гексацианоферрат(П) калия и гексацианоферрат(Ш) калия: K4[Fe(CN)6] и K3[Fe(CN)6] осаждают катионы цинка в виде соответствующих комплекных соединений, а катионы олова в виде гидроксидов.
3ZnCl2 + 2K4[Fe(CN)6] = Zn3K2[Fe(CN)6]2¯ + 6KCl
3ZnCl2 + 2K3[Fe(CN)6] = Zn3[Fe(CN)6]2¯ + 6KCl
2SnCl2 + K4[Fe(CN)6] + 2H2O = 2Sn(OH)2¯ + H4[Fe(CN)6] + 4KCl
Осадки комплексных соединений цинка-калия нерастворимы в воде и в разбавленных кислотах, поэтому катионы цинка с растворами K4[Fe(CN)6] и K3[Fe(CN)6] дают возможность открывать катионы цинка при малых концентрациях.
7. Сероводород (или сероводородная вода) осаждает из аммиачных растворов катионы алюминия и хрома, частично цинка; из уксуснокислых растворов H2S осаждает только катионы цинка в виде белого осадка ZnS↓, а из солянокислых только катионы олова SnS - осадок темно- коричневого цвета.
Из аммиачных растворов:
2
 NH4OH
+ H2S
(NH4)2S
+ 2H2O
NH4OH
+ H2S
(NH4)2S
+ 2H2O
Al2(SO4)3 + 3(NH4)2S = Al2S3¯ + (NH4)2SO4
A l2S3¯ + 6H2O 2Al(OH)3 + 3H2S (гидролиз)
__________________________________________________
Al2(SO4)3 + 6NH4OH = 2Al(OH)3 + 3(NH4)2SO4
Aналогично протекает процесс с катионами хрома Cr3+.
Из уксуснокислых растворов:
ZnCl2 + H2S = ZnS¯ + 2HCl
HCl + CH3COONa = CH3COOH + NaCl
____________________________________________________
ZnCl2 + H2S + 2CH3COONa = ZnS¯ + 2NaCl + 2CH3COOH
ZnS - осадок белого цвета, растворим в минеральных кислотах. При этой реакции очень часто из раствора выпадает сера (серо-желтоватого цвета), которая может маскировать осадок ZnS, но в отличие от ZnS, сера не растворяется в соляной кислоте, поэтому полученный осадок необходимо испытывать на растворимость его в HCl.
Характерные и специфические реакции катионов алюминия.
1. Гидролиз щелочных растворов гидроксида алюминия Al(OH)3 в присутствии хлорида аммония NH4Cl. Данной реакции мешают только соли хрома, которые при нагревании, даже в присутствии NH4Cl, полностью гидролизуются.
Выполнение реакции. К 1-2 мл анализируемого раствора (в отсутствии катионов хрома), приливают небольшой избыток щелочи NaOH, если осадок полностью не раствориться, его центрифугируют. К полученному центрифугату прибавляют несколько кристалликов NH4Cl или приливают насыщенный его раствор и нагревают до кипения. При наличии в фильтрате алюминия образуется белый аморфный осадок гидроксида алюминия Al(OH)3. В этой реакции не должно быть большого избытка щелочи, т.к. избыток щелочи в растворе препятствует гидролизу соли алюминия. Щелочь дает с алюминием комплекс Na3[Al(OH)6].
2. Ализарин и его производные (ализарин S и пурпурин-сульфокислый натрий) в аммиачной среде с катионами алюминия образуют нерастворимые в воде и уксусной кислоте соединения, которые обладают характерной оранжево-красной, а при значительных концентрациях алюминия – ярко-малиновой или темно-красной окраской.
Реакция алюминия с ализарином протекает:
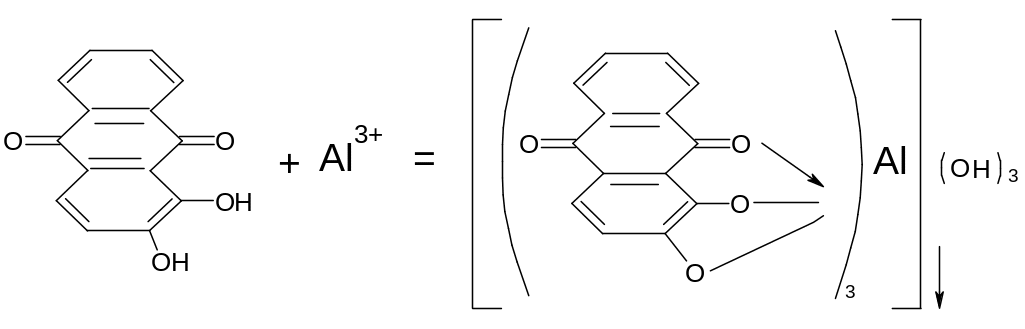
Ализарин - сульфокислый натрий в продаже известен под названием ализарин S, а пурпурин – сульфокислый Na называется ализарин PS.
Ализарин имеет желтую окраску, а производные имеют красную окраску, которые чаще всего используют для открытия катионов алюминия. Для анализа используют насыщенные спиртовые растворы производных ализарина. Реакция эта проводиться следующим образом: к 0,5-1 мл раствора соли алюминия прибавляют 3-4 капли раствора ализарина, 3-4 капли NaOH, 0,5-1 мл разбавленного раствора аммиака NH4OH и нагревают до кипения. При этом раствор принимает красновато-фиолетовый цвет, который обусловлен окраской ализарина в щелочной среде (образуется ализарин аммония – соединение ализарина с аммиаком). Затем к раствору приливают равный объем уксусной кислоты, которая разрушает ализарин аммония (разлагает на ализарин и аммиак), но не взаимодействует с алюминиевым соединением. Через 1-2 минуты из раствора выпадают оранжево-красного или малинового цвета хлопья осадка алюминия. Реакция алюминия с ализарином характерна, но не специфична, так как катионы хрома, цинка, олова образуют окрашенные осадки, однако эти катионы мешают открытию алюминия только в том случае, если их концентрация в десятки раз превышает концентрацию алюминия. Из других групп мешают катионы: Fe3+, Ba2+, Sr2+, Ca2+, Sb3+, Bi3+, Cu2+, Cd2+. Не образуют осадки только катионы первой аналитической группы, Ni2+, Mn2+, Mg2+, Ag+, Hg2+, Pb2+. Катионы алюминия при помощи ализарина, без удаления из раствора всех мешающих катионов, легко можно обнаружить капельным методом.
Выполнение реакции. На полоску фильтровальной бумаги помещают каплю гексацианоферрата(П) калия K4[Fe(CN)6], затем в центр пятна наносят каплю исследуемого раствора на алюминий. Полученное таким образом на бумаге новое пятно, состоит из окрашенного осадка (в центре пятна) и водянистого бесцветного периферийного кольца. Осадок состоит из солей мешающих катионов в растворе 4 группы и других.
В бесцветном кольце вокруг данного осадка содержится алюминий, полученное пятно обрабатывают парами аммиака (держат фильтровальную полоску над склянкой с концентрированным раствором аммиака). При этом катионы алюминия переходят в осадок Al(OH)3. Затем периферическую часть пятна смачивают раствором ализарина и снова держат полоску в парах аммиака. При этом на фиолетовом фоне вокруг центрального пятна образуется оранжево-красная зона, указывающая на присутствие катионов алюминия. Отчетливо проявляется окраска (оранжево-красная), если бумагу высушить. Этим методом открытию катионов алюминия не мешают катионы 4,5,6 групп, мешают только катионы третьей аналитической группы.
Следующий, дробный способ дает возможность открывать катион алюминия Al3+ ализарином непосредственно из анализируемого раствора, содержащих смесь всех аналитических групп. К 1-2 мл нейтрального анализируемого раствора прибавляют небольшое количество цинкового порошка Zn или 2-3 небольших кусочка гранулированного цинка и 2-3 минуты кипятят. При этом некоторые катионы восстанавливаются до свободного металла.. Затем, не отделяя осадка, прибавляют небольшое количество раствора хлорида хрома CrCl3 или хромовых квасцов для соосаждения цинка, равный объем горячего 2н раствора NaOH, к которому добавлена 5-7 капель Na2CO3. Карбонат натрия Na2CO3 добавляют для осаждения катионов третьей аналитической группы, снова кипятят. При этом все катионы за исключением катионов первой аналитической группы и алюминия и незначительно Sn2+ переходят в осадок, полученный осадок отделяют центрифугированием, к центрифугату добавляют 2-3 капли H2O2 для окисления Sn2+ → Sn4+. Sn4+ с ализарином лака не образует. Центрифугат нейтрализуют HCl, до появления мути, приливают NH4OH до появления явного запаха аммиака и около 0,5 мл ализарина. После кипячения раствора прибавляют избыток уксусной кислоты CH3COOH. Через 1 минуту из раствора выпадают мелкие, тяжелые темно-красного цвета хлопья алюминиевого осадка.
3. Открытие алюминия в виде «тенаровой сини».
Полоску фильтровальной бумаги смачиваем исследуемым раствором и раствором нитрата кобальта Co(NO3)2, а затем полоску сжигают в фарфоровой чашке или фарфоровой пластинке. Если исследуемый раствор содержит алюминий Al3+, то образующийся при этом пепел приобретает темно-синюю окраску («тенарова синь»). Из катионов пятой аналитической группы мешает только цинк, а из других групп катионов мешают: Cr3+, Cu2+, Ni2+.
4. Алюминон (аммонийная соль ауринтрикарбоновой кислоты) дает с катионами алюминия внутрикомплексную соль, имеющую красную окраску.
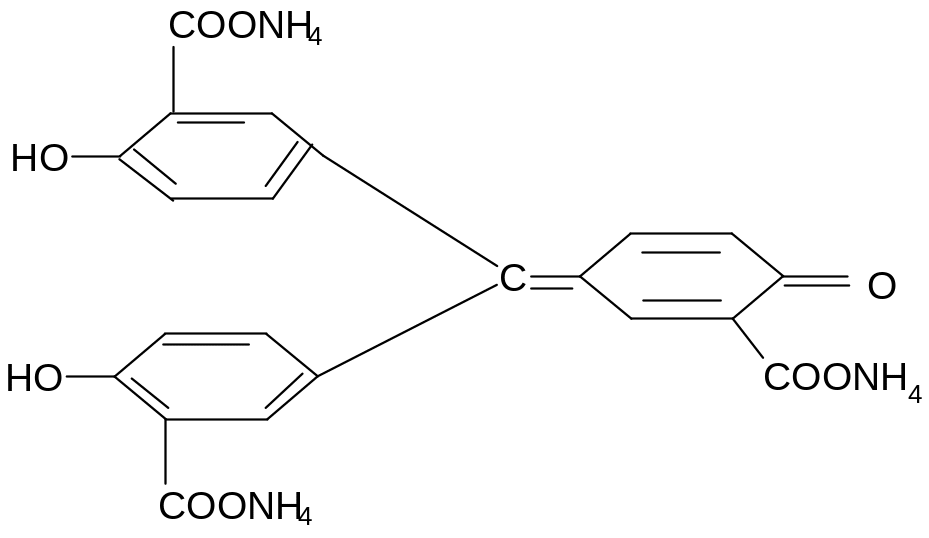
5. Действие ацетата натрия.
Ацетат натрия дает с растворами солей алюминия белый хлопьевидный осадок соли алюминия.
AlCl3 + 3CH3COONa = Al(CH3COO)3 + 3NaCl
A l(CH3COO)3 + 2H2O Al(OH)2(CH3COO)¯ + 2CH3COOH
Выполнение: к 5-6 каплям раствора соли алюминия прилить равный объем реактива. Разбавить раствор водой вдвое и кипятить. Более эффективно действует добавление CH3COONa в твердом состоянии.
Характерные и специфические реакции катионов хрома.
1) Реакции соосаждения и гидролиза.
Наиболее характерными из общеаналитических реакций являются: соосаждение гидроксидов хрома и цинка в виде нерастворимого в избытке щелочей цинката хрома Cr2(ZnO2)3 и реакция полного гидролиза солей хрома при нагревании.
Если к 0,5-1,0 мл анализируемого раствора прилить избыток 2н раствора NaOH, то полное растворение образующегося вначале осадка гидроксидов указывает на то, что совместного наличия катионов хрома и цинка в растворе нет; в нем могут присутствовать лишь или катионы хрома или катионы цинка, или отсутствуют в анализируемом растворе. Полученный щелочной раствор (без осадка) прокипятить 1-2 минуты, то при наличии в нем хрома выпадает осадок гидроксида хрома Cr(OH)3↓.
Если при добавлении к анализируемому раствору избытка щелочи осадок гидроксидов полностью не растворится, это говорит о том, что в растворе имеются катионы хрома и цинка. Данной реакцией для обнаружения катионов Cr3+ и Zn2+ можно пользоваться лишь в том случае, если в растворе присутствуют лишь те катионы, которые со щелочами не образуют осадка, или образуют амфотерные гидроксиды.
2) Окисление катионов хрома.
Наиболее характерной и специфической реакцией на катион хрома, дающей возможность открывать их в присутствии всех других катионов, является реакция окисления. Cr3+ → CrO5
Cr3+ → Cr(OH)3 → [Cr(OH)6]3- → (CrO4)2- → (Cr2O7)2-→ CrO5
Соли хрома Cr3+ имеют темно-синюю окраску.
1. Cr2(SO4)3 + 6NaOH = 3Na2SO4 + 2Cr(OH)3↓
серо-зеленый цвет
2. 2Cr(OH)3↓+ 3NaOH = Na3[Cr(OH)6] гексагидроксохромат(Ш) натрия
избыток ярко-зеленый
3 .
2Na3[Cr(OH)6]
+ 3H2O2
= 2Na2CrO4
+ 2NaOH + 8H2O
.
2Na3[Cr(OH)6]
+ 3H2O2
= 2Na2CrO4
+ 2NaOH + 8H2O
[ Cr(OH)6]3-
+ 2OH-
-
3e → (CrO4)2-
+ 4H2O
2 H – O -- O – H
Cr(OH)6]3-
+ 2OH-
-
3e → (CrO4)2-
+ 4H2O
2 H – O -- O – H
H
 2O2
+
2e → 2OH-
3
2O2
+
2e → 2OH-
3
2[Cr(OH)6]3- + 4OH- + 3H2O2 → 2(CrO4)2- + 6OH- + 8H2O
2Na2CrO4 - желтый
4. В кислой среде хромат-ион переходит в дихромат-ион оранжевой окраски.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 - оранжевый
5. Na2Cr2O7 + H2SO4 + 4H2O2 = 2CrO5 + Na2SO4 + 5H2O
( Cr2O7)2- + 3H2O – 8e → 2CrO5 + 6H+ 1 H – O -- O – H
H

 2O2
+ 2H+
+ 2e → 2H2O
4 2H+→
2H2O
2O2
+ 2H+
+ 2e → 2H2O
4 2H+→
2H2O
(Cr2O7)2- + 3H2O + 4H2O2 + 8H+ → 2CrO5 + 6H+ + 8H2O
2 5
Пероксид хрома - раствор синего цвета, степень окисления хрома в данном соединении (+6):
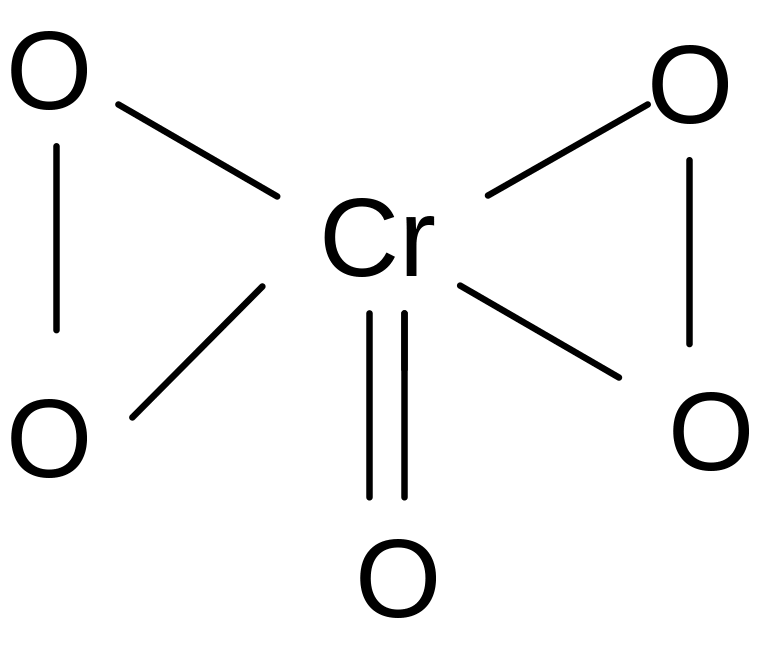
Все данные реакции можно провести в одной пробирке. К анализируемому раствору, содержащему катионы хрома приливают эквивалентное количество щелочи, образуется осадок серо-зеленого цвета, добавляем избыток щелочи – осадок растворяется и переходит в раствор ярко-зеленой окраски – гексагидроксо (Ш) хромата натрия. К этому зеленому щелочному раствору в данной пробирке приливаем каплями пероксид водорода H2O2, перемешиваем, получаем раствор желтого цвета хромата, к желтому раствору приливаем 0,5 мл H2SO4, 0,5 мл эфира, 0,5 мл H2O2. Пробирку закрываем пробкой, и смесь сильно взбалтываем и даем смеси отстояться. В присутствии катионов хрома верхний эфирный слой окрашивается в синий цвет. Пероксидное соединение хрома неустойчиво, поэтому в пробирку и добавляют эфир, где это соединение сохраняется долго.
3) Окисление перманганатом или пероксиддисульфатом аммония.
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 5H2Cr2O7 + 6MnSO4 + 6H2SO4 + 3K2SO4
2 Cr3+
+ 7H2O
– 6e → (Cr2O7)2-
+ 14H+
5
Cr3+
+ 7H2O
– 6e → (Cr2O7)2-
+ 14H+
5
(MnO4)- + 8H+ + 5e → Mn2+ + 4H2O 6

1 0Cr3+
+ 35H2O
– 6 (MnO4)-
+ 48H+
→
5(Cr2O7)2-
+ 70H+
+ 6Mn2+
+ 24H2O
0Cr3+
+ 35H2O
– 6 (MnO4)-
+ 48H+
→
5(Cr2O7)2-
+ 70H+
+ 6Mn2+
+ 24H2O
11 22
При реакции применяют только серную H2SO4 или азотную кислоту HNO3, но не соляную, так как соляная кислота сама окисляется перманганатом калия.
Выполнение реакции. В пробирку помещают 5 капель исследуемого раствора, прибавляют 3 капли 2н раствора H2SO4 или HNO3, 3 капли 0,1н раствора KMnO4 и кипятят 3-5 минут, раствор окрашивается в оранжевый цвет, далее прибавляют эфир и пероксид водорода – раствор синеет CrO5.
Пероксиддисульфат аммония (NH4)2S2O8 в структурном виде:
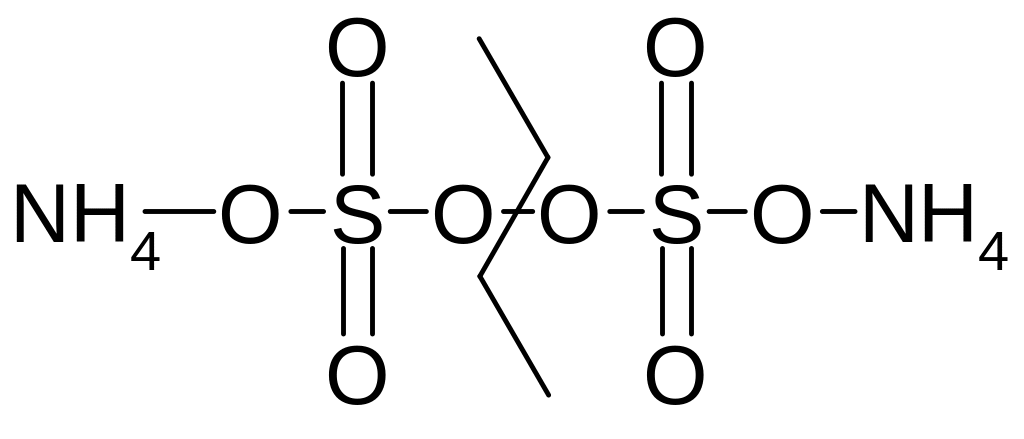
В окислительно-восстановительной реакции рвется связь в кислородном мостике пероксиддисульфата аммония:
C r2(SO4)3 + 3(NH4)2S2O8 + 7H2O = H2Cr2O7 + 3(NH4)2SO4 + 6H2SO4
2Cr3+ + 7H2O - 6e → Cr2O72- + 14H+ 2 1
S2O82- +2e → 2SO42- 6 3
2Cr3+ + 3S2O82- + 7H2O → Cr2O72- + 14H+ + 6SO42-
Окисление проводят пероксиддисульфатом аммония в кислой среде в присутствии нитрата серебра. Ион серебра Ag+ является катализатором в этой реакции. Пероксиддисульфат-ион реагирует сначала с ионом серебра Ag+, переводя его в ион двухзарядного серебра Ag2+:
2Ag+ + S2O82- = 2Ag2+ + 2SO42-
Двухзарядное серебро окисляет хром Cr3+в кислой среде до Cr2O72-:
2Cr3+ + 6Ag2+ + 7H2O = Cr2O72- + 6Ag+ + 14H+
Выполнение реакции. В пробирку помещают 2-3 капли 2н HNO3 или H2SO4, 2-3 капли 0,1н раствора AgNO3, 2-3 капли анализируемого раствора и 2-3 капли пероксиддисульфата аммония (50%); смесь кипятят 2 минуты, охлаждают, раствор окрашивается в оранжевый цвет. При окисление хрома до CrO5 лучше пользоваться пероксиддисульфатом аммония, так как последний при своем восстановлении не образует никаких осадков и раствор его бесцветный. Данная методика окисления хрома служит для открытия Cr3+не только из смеси катионов группы амфотерных гидроксидов, но и всех остальных аналитических групп.
Нитрат серебра осаждает кирпично-красный осадок хромата серебра Ag2CrO4, который растворяется в азотной кислоте и растворе аммиака.
K2CrO4 + 2AgNO3 = Ag2CrO4↓ + 2KNO3
Ag2CrO4↓ + 6NH4OH = 2[Ag(H3N)2]OH + (NH4)2CrO4 + 4H2O
