
- •Содержание
- •1 Общая информация к лабораторным работам
- •1.1 Общие правила и меры безопасности при работе в лаборатории
- •1.2 Особенности методов и средств оценки окружающей среды
- •2 Рекомендации по методике проведения работ
- •2.1 Приготовление растворов, образцов, сред.
- •2.2 Использование тест-систем.
- •2.3 Использование индикаторных трубок.
- •2.4 Использование тест-комплектов.
- •Опыт 2. Изучение состава атмосферных осадков и питьевой воды.
- •Опыт 3. Изучение состава почвы.
- •Контрольные вопросы
- •Лабораторная работа №2. Анализ влияния качества окружающей среды на здоровье человека Опыт 1. Оценка качества продуктов питания по содержанию в них нитратов.
- •Опыт 2. Воздействие неблагоприятных факторов среды на организм человека.
- •Опыт 3. Влияние неблагоприятных факторов среды на свойства белка
- •Контрольные вопросы
- •Лабораторная работа №3 Анализ загрязнений окружающей среды
- •Опыт 1. Изучение запыленности воздуха в помещении и на улице.
- •Опыт 2. Влияние загрязнения воздуха на живые организмы.
- •Опыт 3. Методы обнаружения тяжелых металлов в окружающей среде.
- •Опыт 4. Экспресс-анализ загрязнений сточных вод и водоемов.
- •Опыт 6. Оценка загрязнения почвы путем химического анализа вытяжек
- •Опыт 6. Моделирование влияния химического загрязнения среды на живые организмы.
- •Опыт 7. Определение антропогенных нарушений почвы
- •Контрольные вопросы
- •Лабораторная работа №4. Технологии очистки окружающей среды Опыт 1. Очистка воздуха от диоксида углерода.
- •1, 2, 8, 10 – Штуцер; 3, 9 – трехходовой кран; 4 – абсорбер; 5 – насадка; 6, 7 – коническая колба; 11 – сосуд Мариотта; 12 – зажим
- •1, 2, 7, 9 – Штуцер; 3, 8 – трехходовой кран; 4 – адсорбер; 5 – поглотитель (цеолит); 6 – коническая колба
- •Опыт 2. Очистка воды различными методами.
- •Опыт 3. Проблема утилизации твердых отходов на примере полиэтилена.
- •Контрольные вопросы
Опыт 2. Изучение состава атмосферных осадков и питьевой воды.
Вводная информация:
Дождевая (снеговая) вода обычно имеет слабокислые свойства. Происходит это, как правило, вследствие растворения в ней диоксида углерода СО2. Проблемы, связанные с кислотным или щелочным загрязнением атмосферной воды, происходят чаще всего из-за деятельности человека. Причиной возникновения кислотных дождей являются массовые промышленные выбросы оксида серы (IV) SO2 и оксидов азота NOx в атмосферу. В результате окисления этих веществ кислородом воздуха и взаимодействия с атмосферной влагой происходит образование азотистой (HNO2), азотной (HNO3), сернистой (H2SO3) и серной (H2SO4) кислот.
Изменения кислотности воды водоема обычно могут вызвать загрязнения воздуха кислотными примесями, которые «вымываются» из воздуха дождями и попадают в водоем, а также загрязнения промышленными сточными водами. Кислотность природной воды может определяться также характером почвогрунтов ландшафта, в котором расположен водоем.
Кислотность воды определяется значением водородного показателя (рН), который для природных вод обычно имеет значения от 6,5 до 8,5. Изменение рН природной воды сверх этих пределов создает среду, непригодную для существования большинства водных организмов, особенно простейших.
Качество природной воды в значительной степени определяется концентрацией растворенных в ней минеральных солей. Можно выделить два больших класса минеральных солей, которые встречаются в природной воде в значительных концентрациях (см. табл. 1).
Основной вклад в общее солесодержание вносят соли 1-го класса, которые следует определять в первую очередь. Соли 2-го класса также необходимо учитывать при оценке качества воды, т.к. на каждую из них установлено значение ПДК, хотя они вносят незначительный вклад в общее солесодержание природных вод. Концентрации растворенных в воде минеральных солей определяют методами аналитической химии.
В первую очередь нарушенный минеральный состав воды сказывается на жизнедеятельности простейших организмов. Повышенная концентрация солей в воде пагубно сказывается на минеральном составе окружающей водоем почвы, вызывая ее засоление, как в процессе впитывания воды почвой, так и при орошении такой водой сельскохозяйственных полей. Источниками обогащения природной воды минеральными солями являются: посыпаемые солями зимой улицы городов и дороги; поля и газоны после применения на них минеральных удобрений; неочищенные сточные воды и рассолы, сбрасываемые промышленными предприятиями, и др. Повышенная концентрация солей ухудшает вкус питьевой воды. При концентрациях солей, превышающих соответствующие ПДК, вода становится непригодной для питья и использования на хозяйственные нужды.
Таблица 1
Основные компоненты, создающие минерализацию питьевой и природной воды
Компонент минерального состава воды |
ПДК, мг/л |
Компонент минерального состава воды |
ПДК, мг/л |
1-й класс |
2-й класс |
||
Катионы: |
Катионы |
||
Кальций Са2+ |
200 |
Аммоний NH4+ |
2,5 |
Натрий Na+ |
200 |
Железо общее Fe2+ Fe3+ |
0,3 |
Магний Mg2+ |
100 |
Металлы |
0,001(ммоль/л) |
Анионы |
Анионы |
||
Гидрокарбонат HCO3– |
1000 |
Фосфат PO43– |
3,5 |
Сульфат SO42– |
500 |
Нитрит NO2– |
0,1 |
Хлорид CI– |
350 |
|
|
Карбонат CO3– |
100 |
|
|
Нитрат NO3– |
45 |
|
|
Примечание: ПДК приведены для воды поверхностных источников хозяйственно-питьевого назначения.
Жесткость воды – одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. К солям жесткости относятся, главным образом, соли кальция (Са+) и магния (Mg2+). Жесткость, обусловленная присутствием в воде гидрокарбонатов (HCO3–), называется временной, или карбонатной. Она устраняется при кипячении воды (точнее, при температуре более 60°С):
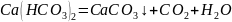 .
.
Жесткость, обусловленная присутствием хлоридов (Сl–) или сульфатов (SО42–), называется постоянной, или некарбонатной. Она устраняется добавлением соды, фосфата натрия и других химикатов.
На правильность полученных результатов анализов влияет способ отбора пробы воды (осадков, питьевой) и условия ее хранения. Проба должна быть отобрана в чистую стеклянную или пластмассовую бутыль объемом не менее 0,5 л (в бутыли должно остаться не более 5-10 мл воздуха); пробы следует анализировать в течение нескольких часов после отбора либо хранить в холодильнике.
Цель опыта: изучение и анализ состава атмосферных осадков и питьевой воды, методов устранения жёсткости воды.
Оборудование и материалы: ложка, ножницы, пинцет, пробирки, штатив для пробирок, пипетка, держатель для пробирок, спиртовка, спички; раствор йода, раствор дифениламина в концентрированной серной кислоте, раствор соли бария (насыщенный), раствор соляной кислоты (1:5), раствор нитрата серебра (1%), раствор мыла; проба осадков (дождевая или талая вода), проба питьевой воды (водопроводная или минеральная), тест-комплект или тест-система «рН», тест-комплекты «Общая жесткость», «Хлориды», «Нитраты», «Сульфаты».
Ход работы:
Качественные реакции проводят в пробирках, наполняя их исследуемыми пробами воды до метки «5 мл», предварительно ополоснув исследуемой водой. Количественные измерения выполняют с применением тест-комплектов согласно инструкциям к ним (см. 2.4.).
Демонстрация жесткости воды. Добавьте в пробирки с модельными образцами жесткой воды (временная и постоянная жесткость) по 1 мл раствора мыла. Опишите наблюдаемое.
Демонстрация устранения временной жесткости. Налейте в пробирку модельную воду с временной жесткостью и доведите воду до кипения с помощью горелки. В случае образования осадка после кипячения дайте ему отстояться, а раствор перелейте в другую пробирку. С помощью раствора мыла убедитесь, что жесткость устранена.
Демонстрация устранения постоянной жесткости. В пробирку, содержащую модельную воду с постоянной жесткостью и раствор мыла, добавьте 2-3 мл раствора соды и встряхните пробирку. Опишите наблюдаемое и напишите уравнение реакции.
Определение рН исследуемых проб воды (осадков, питьевой). Проводится с помощью тест-комплекта «рН» или тест-системы «рН».
Определение жесткости исследуемых проб воды. Определите общую жесткость с помощью тест-комплекта «Общая жесткость». Устраните временную жесткость, как описано выше. Определите оставшуюся (постоянную) жесткость с помощью тест-комплекта «Общая жесткость».
Обнаружение хлорид-ионов. Добавьте в пробирки с исследуемыми пробами по каплям раствор нитрата серебра. При наличии хлорид-ионов наблюдается выпадение белого творожистого осадка или помутнение раствора (если содержание хлорид-ионов незначительно). В этом случае проведите количественный анализ с помощью тест-комплекта «Хлориды».
Обнаружение нитрат-ионов. Добавьте в пробирки с исследуемыми пробами 2-3 капли раствора дифениламина. При наличии нитрат-ионов раствор окрашивается в синий цвет. В этом случае проведите количественный анализ с помощью тест-комплекта «Нитраты».
Обнаружение сульфит-ионов. Добавьте в пробирки с исследуемыми пробами 10 капель раствора соляной кислоты (1:5) и 1-2 капли раствора йода. При наличии сульфит-ионов раствор обесцвечивается.
Обнаружение сульфат-ионов. Добавьте в пробирки с исследуемыми пробами 10 капель раствора соляной кислоты (1:5) и 2 капли раствора соли бария. При наличии сульфат-ионов в течение 3 мин раствор мутнеет. Количественное определение содержания сульфат-ионов при необходимости выполните с помощью тест-комплекта «Сульфаты».
Зафиксируйте результаты экспериментов в тетради в табличной форме. Используя полученные результаты экспериментов, сделайте вывод о возможных источниках загрязнения осадков и питьевой воды. Напишите соответствующие уравнения химических реакций.
Исследуемая вода |
рН |
Временная жесткость |
Постоянная жесткость |
Cl– |
NO3– |
SO32– |
SO42– |
Атмосферные осадки |
|
|
|
|
|
|
|
Питьевая вода |
|
|
|
|
|
|
|
