
- •Эффективный заряд атома
- •Способы образования ковалентной связи
- •1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденныхатомах.
- •Водородная связь
- •Строение молекулы аммиака
- •Сродство к электрону
- •Электроотрицательность элементов
- •Метод валентных связей
Строение молекулы аммиака
Валентная структура молекулы:
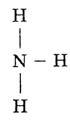
Пространственное строение: молекула аммиака имеет пирамидальное строение. В вершине пирамиды азот. В углах треугольника, лежащего в основании пирамиды, атомы водорода.
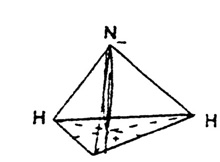
Перпендикуляр, опущенный из вершины пирамиды на основание - это вектор, показывающий, что молекула аммиака полярна (диполь). Электронная плотность смещена в сторону более электроотрицательного атома — азота. Поэтому он заряжается отрицательно.
Строение молекулы метанаCH(4)
В предельных углеводородах атомы углерода находятся в первом валентном состоянии (sp3-гибpидизaция). В этом случае, .как известно, все четыре гибридные орбитали в пространстве составляют геометрическую фигуру — тетраэдр (углы между осями связей С—Н равны 109° 28').
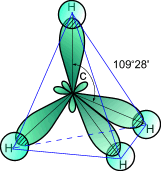
В молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер. Если перекрывающиеся попарно электронные облака при образовании связей обозначить двумя точками или валентной черточкой, строение метана можно выразить формулами:
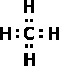 или
или 
Неполярная и полярная ковалентные связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Химическая связь – взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. Атом на внешнем энергетическом уровне способен содержать от одного до восьми электронов. Валентные электроны – электроны предвнешнего, внешнего электронных слоев, участвующие в химической связи. Валентность – свойство атомов элемента образовывать химическую связь.
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Общая электронная пара осуществляется через обменный или донорно-акцепторный механизм. Обменный механизм образования ковалентной связи – спаривание двух неспа-ренных электронов, принадлежащих различным атомам. Донорно-акцепторный механизм образования ковалетной связи – образование связи за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Есть две основные разновидности ковалентной связи: неполярная и полярная.
Ковалентная неполярная связь возникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
Ковалентная полярная связь возникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью.
Чем сильнее перекрываются электронные облака, тем прочнее ковалентная связь.
Электроотрицательность – способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Свойства ковалентной связи: 1) энергия; 2) длина; 3) насыщаемость; 4) направленность.
Длина связи – расстояние между ядрами атомов, образующих связь.
Энергия связи – количество энергии, необходимое для разрыва связи.
Насыщаемость – способность атомов образовывать определенное число ковалентных связей.
Направленность ковалентной связи – параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Гибридизация – выравнивание орбиталей по форме и энергии. Существует несколько форм перекрывания электронных облаков с образованием ?-связей и ?-связей (?-связь намного прочнее ?-связи, ?-связь может быть только с ?-связью).
ЭНЕРГИЯ СВЯЗИ, энергия, которую следует придать ядру атома для того, чтобы расщепить его на составляющие элементы (нейтроны и протоны). Перед тем, как ядро подвергнется делению (кроме случаев радиоактивного распада), оно должно получить необходимое количество этой энергии.
Ядро – система связанных
нуклонов, состоящая из Z протонов (масса
протона в свободном состоянии mp)
и N нейтронов (масса нейтрона в свободном
состоянии mn).
Для того, чтобы разделить ядро на
составные нуклоны, нужно затратить
определенную минимальную энергию W,
называемую энергией связи. При этом
покоящееся ядро с массой М переходит в
совокупность свободных покоящихся
протонов и нейтронов с суммарной массой
Zmp + Nmn.
Энергия покоящегося ядра Мс2.
Энергия освобождённых покоящихся
нуклонов (Zmp + Nmn)с2.
В соответствии с законом сохранения
энергии Мс2 + W = (Zmp + Nmn)с2.
Или W = (Zmp + Nmn)с2 -
Мс2.
Поскольку W > 0, то М < (Zmp + Nmn),
т.е. масса, начального ядра, в котором
нуклоны связаны, меньше суммы масс
свободных нуклонов, входящих в его
состав.
W растёт с увеличением числа А нуклонов
в ядре (А = Z + N). Удобно иметь дело с
удельной энергией связи ![]() =
W/A, т.е.
средней энергией связи, приходящейся
на один нуклон. Для большинства ядер
=
W/A, т.е.
средней энергией связи, приходящейся
на один нуклон. Для большинства ядер
![]() 8
МэВ (1
МэВ = 1.6.10-13 Дж). Для
разрыва химической связи нужна энергия
в 106 раз
меньше.
8
МэВ (1
МэВ = 1.6.10-13 Дж). Для
разрыва химической связи нужна энергия
в 106 раз
меньше.
