
- •Химико-технологические системы
- •Содержание
- •2. Методические указания к изучению дисциплины
- •3. Методические указания к выполнению контрольных заданий
- •4. Контрольные задания
- •5. Требования к оформлению контрольной работы
- •6. Список рекомендуемой литературы
- •Приложение а
- •Содержание дисциплины «хИмико-тЕхНологические системы»
- •Тема 1. Химико-технологические процессы и химико-технологические системы
- •Тема 2. Химическая термодинамика
- •Тема 3. Химическое равновесие
- •Тема 4. Фазовые равновесия
- •Приложение б
- •Форма первой страницы титульного листа контрольной работы
- •«ХИмико-тЕхНологические системы»
- •Санкт-Петербург
- •Приложение в
- •Перечень контрольных вопросов для проверки знаний по дисциплине «хИмико-тЕхНологические системы»
- •Приложение г
- •Диаграммы перегонки двухкомпонентных систем
2. Методические указания к изучению дисциплины
При изучении дисциплины студент должен руководствоваться рабочей программой, пользоваться литературой, рекомендованной данными методическими указаниями, или использовать любой дополнительный источник.
Рабочая программа по дисциплине “Химико-технологические системы” построена таким образом, что вначале студент знакомится с общей характеристикой и показателями качества ХТС. Затем изучаются методы системного декомпозизионного анализа химико-технологических систем. Первый этап – рассмотрение системы на молекулярном уровне. Здесь понадобятся знания, полученные при изучении дисциплин “Теоретические основы прогрессивных технологий”, “Основы физической химии”, а также знание методов дифференциального и интегрального исчисления, которые изучались в курсе высшей математики. На первом уровне анализа ХТС рассматривается также термодинамика химических реакций и химическое равновесие. На втором этапе изучаются фазовые равновесия одно- и многокомпонентных систем. На уровне потоков и реакторов химико-технологические системы изучаются позднее в курсе “Процессы и аппараты, их конструирование для химических производств”. Анализ на уровне химико-технологической системы проводится с учетом взаимных связей между реакторами, теплообменниками, смесителями и другими аппаратами, используемыми для переработки сырья в конечные продукты. Такой анализ конкретных химико-технологических процессов и систем будет проводиться при изучении дисциплин “Технология химических производств” и “Основы химического синтеза”.
Содержание дисциплины “Химико-технологические системы”, по основным ее разделам: химико-технологические процессы и химико-технологические системы, химическая термодинамика, химическое равновесие, фазовые равновесия приводится в приложении А.
Прежде, чем приступать к выполнению контрольных заданий, необходимо изучить теоретический материал соответствующего раздела рабочей программы по учебникам, приведенным в списке рекомендованной литературы или другим учебникам по физической химии и химической технологии. Для проверки своих знаний воспользуйтесь контрольными вопросами в приложении В. Эти вопросы помогут также при подготовке к экзамену.
3. Методические указания к выполнению контрольных заданий
Для закрепления теоретических знаний, приобретения навыков практического применения основных закономерностей и методов студенты заочной формы обучения выполняют контрольную работу.
Процесс работы над контрольными заданиями является важным этапом подготовки к экзамену по данной дисциплине. Контрольные задания соответствуют содержанию учебной дисциплины, отраженному в рабочей программе, и охватывают основные темы и понятия учебной дисциплины. Соответствие контрольных заданий основным темам представлено в табл. 1:
Таблица 1
№ задания |
Наименование темы |
1 |
Тема 2 и 3. Химическая термодинамика и химическое равновесие |
2 и 3 |
Тема 4. Фазовые равновесия |
Студент должен выполнить одну контрольную работу, которая включает три задания. Задания выполняются по вариантам. Каждый студент выполняет только один из 26 вариантов. Выбор варианта делается по двум последним цифрам номера зачетной книжки в соответствии с табл. 2.
Таблица 2
Две Последние цифры зачетной книжки |
Вариант контрольных заданий |
||
Задание № 1 |
Задание № 2 |
Задание № 3 |
|
01 31 61 91 |
1 |
1 |
1 |
02 32 62 92 |
2 |
2 |
2 |
03 33 63 93 |
3 |
3 |
3 |
04 34 64 94 |
4 |
4 |
4 |
05 35 65 95 |
5 |
5 |
5 |
06 36 66 96 |
6 |
6 |
6 |
07 37 67 97 |
7 |
7 |
7 |
08 38 68 98 |
8 |
8 |
8 |
09 39 69 99 |
9 |
9 |
9 |
Продолжение табл. 2
Две последние цифры зачётной книжки |
Вариант контрольных заданий |
||
Задание № 1 |
Задание № 2 |
Задание № 3 |
|
10 40 70 00 |
10 |
10 |
10 |
11 41 71 |
11 |
11 |
11 |
12 42 72 |
12 |
12 |
12 |
13 43 73 |
13 |
13 |
13 |
14 44 74 |
14 |
14 |
14 |
15 45 75 |
15 |
15 |
15 |
16 46 76 |
16 |
1 |
16 |
17 47 77 |
17 |
2 |
17 |
18 48 78 |
18 |
3 |
18 |
19 49 79 |
19 |
4 |
19 |
20 50 80 |
20 |
5 |
20 |
21 51 81 |
21 |
6 |
21 |
22 52 82 |
22 |
7 |
22 |
23 53 83 |
23 |
8 |
23 |
24 54 84 |
34 |
9 |
24 |
25 55 85 |
25 |
10 |
25 |
26 56 86 |
26 |
11 |
26 |
27 57 87 |
1 |
12 |
1 |
28 58 88 |
2 |
13 |
2 |
29 59 89 |
3 |
14 |
3 |
30 60 90 |
4 |
15 |
4 |
Справочные данные, необходимые для выполнения контрольных заданий, приведены в справочнике [2]. Примеры решения задач, аналогичных контрольным заданиям, приведены в [4].
Наибольшие сложности обычно возникают у студентов при расчетах равновесного состава и равновесного выхода продуктов химической реакции (задания 1.12–1.15), анализе влияния температуры и давления на равновесный выход продуктов в задании № 1, а так же при анализе фазовых равновесий жидкость – пар в двухкомпонентной система (диаграмм перегонки) в задании № 3. Поэтому ниже приводится примеры выполнения данных заданий.
Пример выполнения контрольных заданий:
Задание № 1. Расчет равновесного выхода продукта химической реакции и выбор оптимальных условий проведения процесса.
1.12. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в стехиометрических количествах.
Решение:
2CO + S2 = 2COS Т = 500К
исх. состав 2 1 0
n![]() ,
моль
,
моль
равнов.
сост. 2–2![]() 1–
2
1–
2
n![]() ,
моль
,
моль
![]()
2 –2
>
0
–2
>
0
1– > 0 => 0 < < 1
2 > 0
Кp=
![]()
![]()
![]()
К![]()
К![]() =
=
![]()
При Kp = 3,56·1011 = 0,9998223
1.13. Определите глубину превращения ξ в реакции A при температуре Т и атмосферном давлении при условии, что исходные вещества взяты в количествах CO – 0,2 моль; S2 – 2,0 моль.
Решение:
2CO + S2 = 2COS
исх. состав 0,2 2 0
n![]() ,
моль
,
моль
равн. состав 0,2–2 2– 2
n![]() ,
моль
,
моль
0 ,2-2
>0
,2-2
>0
2- >0 => 0 < < 0,1
2 >0
![]()
К
=
![]()
![]()
= 0,0999997
1.14. Определите степень превращения исходных веществ при условиях 1.12 и 1.13.
Решение:
X
=
![]() =
=![]()
при условии 1.12 = 0,9998
Х![]()
Х![]()
при условии 1.13 =0,0999997
Х![]()
Х![]()
1.15. Определите состав равновесной смеси в мол.% для химической реакции А при температуре Т и атмосферном давлении при условиях 1.12 и 1.13.
Решение:
N![]()
при условии 1.12 = 0,99982
N![]()
N![]()
N![]()
при условии 1.13 =0,0999997
N![]()
N![]()
N![]()
1.16. Установите, как влияет повышение температуры на термодинамическую константу равновесия Ka и равновесный выход продуктов химической реакции А. Ответ аргументируйте, используя соответствующие уравнения химической термодинамики. Сопоставьте сделанные выводы с расчетными значениями констант равновесия.
Решение:
![]()
Знак
производной
![]() определяется знаком ∆Н0
определяется знаком ∆Н0
∆Н0 < 0 (реакция экзотермическая)
![]() < 0,
следовательно, функция lnK
< 0,
следовательно, функция lnK![]() =
f(T)
– убывающая и K
=
f(T)
– убывающая:
=
f(T)
– убывающая и K
=
f(T)
– убывающая:
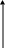
 К
К

Т
Проведенные расчеты подтверждают этот вывод:
К![]() <
К
<
К![]() (п.1.1)
(п.1.1)
Так как К = активность продуктов / активность реагентов, то с уменьшением К уменьшается активность продукта и, следовательно, равновесный выход продукта химической реакции.
1.17. Установите, как влияет повышение общего давления на равновесный выход продуктов химической реакции А. Ответ аргументируйте.
Решение:
K![]() K
K![]() K
K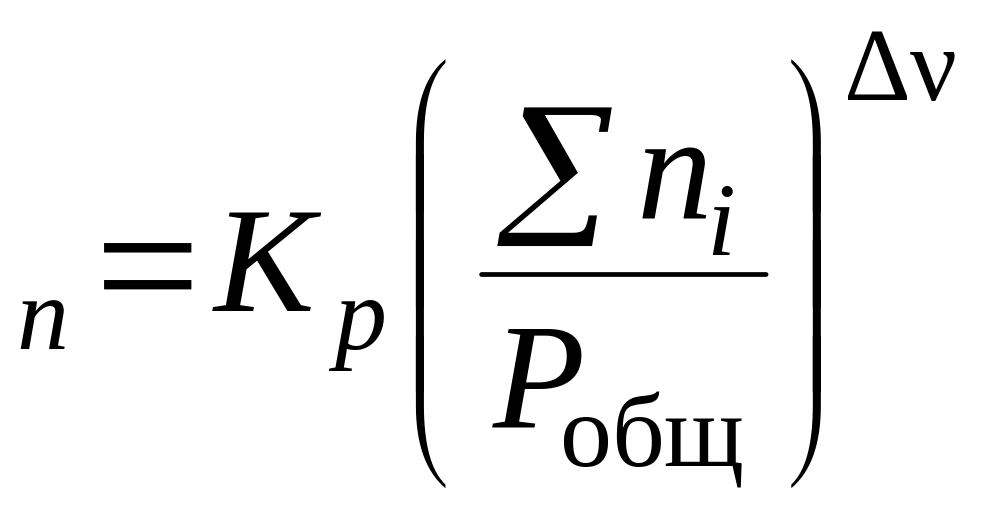
Δ![]() < 0, следовательно, с увеличением
давления Кn
увеличивается и равновесие сместится
в сторону продуктов.
< 0, следовательно, с увеличением
давления Кn
увеличивается и равновесие сместится
в сторону продуктов.
1.18. Сделайте вывод об оптимальных условиях протекания процесса: при каких температурах и давлениях следует проводить реакцию А для получения максимального выхода продуктов. При ответе на данный вопрос учитывайте энергетические и экономические затраты.
Вывод:
С термодинамической точки зрения при увеличении давления и уменьшении температуры увеличивается выход продукта реакции. При 500 К выход продукта = 99,973 мол.%. Но с экономической точки зрения понижение температуры и повышение давления не выгодно, так как тогда требуются дополнительные холодильные аппараты, использование которых требует дополнительных денежных средств. С кинетической точки зрения при стандартной температуре 298 К скорость меньше, чем если ее повысить. Следовательно, следует повысить температуру. Таким образом, оптимальным для данной реакции является Т = 500 К и повышение давления выше нормального атмосферного давления.
Задание № 3. Анализ фазовых равновесий жидкость – пар в двухкомпонентной системе.
3.1. Найдите в приложении Г диаграмму температура кипения – состав заданной в табл. 6 системы A–B. Какую информацию о системе несет данная диаграмма?
Ответ:
Исходные данные из табл.6:
A – B
(C2H5)2O – CCl4
этиловый эфир – четыреххлористый углерод
m = 0,9 кг
а = 70 мол.% А
t = 60ºC
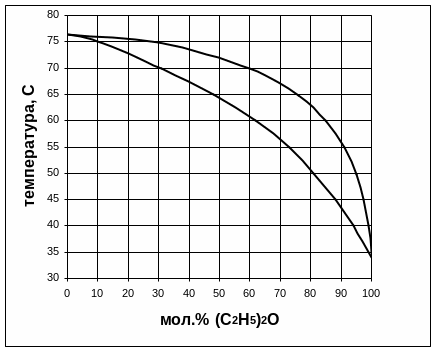
Данная диаграмма показывает равновесие жидкой и парообразной фазы, температуру начала и конца кипения, температуру конденсации. Раствор неидеальный с отрицательным отклонением от закона Рауля.
По диаграмме определите:
3.2. При какой температуре закипит жидкость, содержащая а мол. % вещества A (табл. 4).
Ответ:
При температуре 56ºС закипит жидкость, содержащая 70 мол.% (C2H5)2O.
3.3. При какой температуре вся первоначальная жидкость обратится в пар, если при нагревании пар не отводить?
Ответ:
При температуре 67ºС вся первоначальная жидкость обратится в пар.
3.4. Как будет меняться состав первоначальной жидкости по мере испарения?
Ответ:
Состав первоначальной жидкости по мере испарения будет меняться от 70 до 42 мол.% вещества (C2H5)2O.
3.5. Каков состав первых пузырьков пара?
Ответ:
Состав первых пузырьков пара 89 мол.% (C2H5)2O.
3.6. Как изменяется состав равновесного с кипящей жидкостью пара в ходе испарения?
Ответ:
Состав равновесного с кипящей жидкостью пара в ходе испарения меняется от 89 до 70 мол.% (C2H5)2O.
3.7. Какое количество каждого из компонентов смеси будет находиться в жидкой фазе и в парах, если m кг смеси, заданного состава нагреть до температуры t (табл.4)?
Решение:
m = 0,9кг t = 60ºC
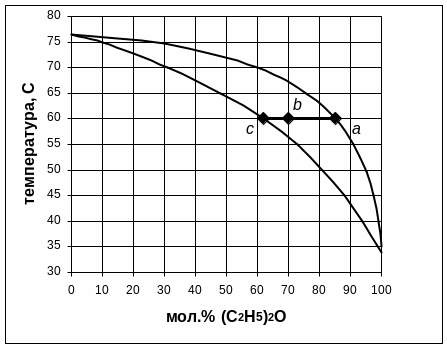
Количество жидкой и парообразной фазы находится по правилу рычага.
![]()
Переведем координаты точек a, b, c из мол.% в масс.%:
масс.%=![]()
![]() :
t
= 60ºC,
N
= 85 мол.% (C2H5)2O
– состав паровой фазы
:
t
= 60ºC,
N
= 85 мол.% (C2H5)2O
– состав паровой фазы
![]() :
t
= 60ºС, N
= 70 мол.% (C2H5)2O
– состав исходной жидкости
:
t
= 60ºС, N
= 70 мол.% (C2H5)2O
– состав исходной жидкости
![]() :
t
= 60ºC,
N
= 62 мол.% (C2H5)2O
– состав жидкости
:
t
= 60ºC,
N
= 62 мол.% (C2H5)2O
– состав жидкости
M((C2H5)2O) = 74 г/моль
М(CCl4) = 154 г/моль
:
![]() (C2H5)2O
(C2H5)2O
:
![]() (C2H5)2O
(C2H5)2O
:
![]() (C2H5)2O
(C2H5)2O
![]()
mж + mп = m
m = 0,9 кг
mп = 0,9 – mж
![]()
![]()
0,261 – 0,29mж = 8,91 mп
mж = 0,03кг
mп = 0,9 – 0,03 = 0,87 кг
В жидкой фазе:
m((C2H5)2O)ж
=
![]()
m(CCl4)ж = mж – m((C2H5)2O)ж = 0,03–0,13=0,017 кг
В паре:
m((C2H5)2O)п
=
![]()
m(CCl4)п = mп – m((C2H5)2O)п = 0,87 – 0,64 = 0,23 кг
Проверка:
![]() =
m((C2H5)2O)ж
+ m(CCl4)ж
+ m((C2H5)2O)п
+m(CCl4)п
= = 0,013 + 0,017 + 0,64 + 0,23 = 0,9 кг
=
m((C2H5)2O)ж
+ m(CCl4)ж
+ m((C2H5)2O)п
+m(CCl4)п
= = 0,013 + 0,017 + 0,64 + 0,23 = 0,9 кг
3.8. Какие продукты можно получить, если подвергнуть жидкость заданного состава
а) перегонке в равновесии (интегральной перегонке);
б) простой (дифференциальной) перегонке;
в) ректификации?
Ответ:
а) Пар не отводится, а находится в равновесии с жидкостью. При этом состав пара меняется по линии от 89 до 70 мол.% (C2H5)2O, а жидкости – по линии от 70 до 42 мол.% (C2H5)2O .
Чистые вещества в результате такой перегонки получить нельзя, а можно получить 2 фракции: жидкую (в перегонном кубе), обогащенную четыреххлористым углеродом, и дистиллят (конденсированный пар), обогащенный диэтиловым эфиром.
б) Пар непрерывно отводится.
При дифференциальной перегонке можно получить чистый четыреххлористый углерод, и он остается в перегонном кубе.
в) Внизу колонны будет собираться практически чистый жидкий компонент ССl4.
Пар на каждой тарелке охлаждается, его состав меняется, обогащаясь (C2H5)2O. Вверху колонны и, соответственно в дистилляте будет получаться чистый диэтиловый эфир.
