
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •Рекомендовано научно-методическим советом университета в качестве учебного пособия
- •© Ярославский государственный технический университет, 2006
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •1.4 Блок- схема установки монохроматора ум-2
- •1.5 Порядок титрования на ум-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Лабораторная работа № 2 анализ смеси красителей с непересекающимися спектрами на фотоколориметре кфк-2
- •Красителей в анализируемой смеси
- •Лабораторная работа № 3 анализ смеси красителей с пересекающимися спектрами на фотоколориметре кфк-2
- •Экстинкции анализируемых веществ
- •Лабораторная работа № 4 определение хрома дифенилкарбазидным методом
- •Лабораторная работа № 5 определение железа в виде трисульфосалицилата
- •Лабораторная работа № 6 определение меди методом дифференциальной фотометрии
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •Лабораторная работа № 7 фотометрическое титрование солей железа с сульфосалициловой кислотой
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование на фотоколориметре кфк-2»
- •Лабораторная работа № 8 фотометрическое титрование смеси протолитов на монохроматоре ум-2
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование смеси протолитов на монохроматоре ум-2»
- •2 Турбидиметрический метод анализа
- •Теоретические основы
- •Лабораторная работа № 9 турбидиметрический анализ сульфат-ионов
- •Вопросы к отчету по лабораторной работе «Турбидиметрический анализ сульфат-ионов»
- •3 Абсорбционная спектроскопия
- •3.2 Использование спектров поглощения для определения константы диссоциации кислотно-основных индикаторов
- •При различном положении равновесия
- •3.3 Блок-схема однолучевого спектрального прибора
- •3.4 Порядок работы на однолучевом спектрофотометре ум-2
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 10 запись спектров поглощения на однолучевом спектрофотометре
- •Анализ смеси невзаимодействующих красителей с пересекающимися спектрами на однолучевом спектрофотометре ум-2
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с пересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •Вопросы к отчету по работе
- •4 Инфракрасная спектроскопия
- •4.1 Теоретические основы
- •Связь с-н в метане
- •И деформационных колебаний
- •4.2 Расшифровка инфракрасных спектров
- •4.3 Блок-схема спектрометра мом-2000
- •4.4 Порядок включения и записи спектров на спектрометре мом-2000
- •Лабораторная работа № 14 идентификация органических соединений методом инфракрасной спектроскопии
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •6 Кинетические методы анализа
- •6.1 Теоретические основы
- •Скорость химической реакции зависит от следующих факторов:
- •В кинетических методах анализа используются различные методы определения концентрации. Среди них выделяют три основные группы методов:
- •По методу тангенсов:
- •По методу тангенсов
- •4) Используя градуировочный график, определяют концентрацию анализируемого вещества в пробе.
- •По методу фиксированного времени
- •Метод фиксированной концентрации
- •По методу фиксированной концентрации
- •По методу добавок
- •В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
- •Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSo4).
- •По методу тангенсов
- •Анализируемого вещества
- •Вопросы к отчету по лабораторной работе
- •Библиографический список
- •Оглавление
- •Учебное издание
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •План 2005
- •150023, Ярославль, Московский пр., 88
- •150028, Ярославль, ул. Советская, 14а
- •Ярославль 2006
В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
(CNS–)
Fe3+
+ 2S2O32–
2Fe2+
+ S4O![]()
Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSo4).
Выполнение работы
1) Работу выполняют на фотоколориметре КФК-2. Порядок включения и работы на приборе смотри в разделе 1.2.
2) Выбирают светофильтр. В предварительно вымытую мерную колбу вместимостью 50 см3 отбирают пипеткой исходные растворы хлорного железа (5 см3), роданида калия (10 см3), тиосульфата натрия (10 см3), объем колбы доводят дистиллированной водой до метки, закрывают пробкой и тщательно перемешивают. Подготавливают две кюветы, одну заполняют приготовленным раствором, другую – дистиллированной водой. Помещают кюветы в кюветное отделение и измеряют абсорбцию раствора со всеми светофильтрами фотоколориметра. Выбирают светофильтр, при котором абсорбция раствора максимальна. Порядок фотометрирования смотри в разделе 1.3.
3) Подбирают оптимальную концентрацию катализатора (объем стандартного раствора сульфата меди). Время протекания химической реакции должно составлять 20 мин. Приготавливают стандартные растворы с различным содержанием катализатора. В каждую колбу вместимостью 50 см3 отбирают раствор хлорного железа (5 см3), роданида калия (10 см3), тиосульфата натрия (10 см3) и раствор сульфата меди, например, в первую колбу – 0,8 см3 и проводят фотометрирование; во вторую – 0,9 см3; и в третью – 1,0 см3 и т.д. Исходный раствор катализатора сульфата меди следует разбавить в 10 раз. После добавления катализатора включают секундомер, затем доводят объем колбы дистиллированной водой до метки, закрывают пробкой, быстро и тщательно перемешивают. Заполняют кювету раствором, затем помещают ее в кюветное отделение фотоколориметра и измеряют абсорбцию через каждую минуту, записывают результаты в таблицу 1. В качестве раствора сравнения используют дистиллированную воду. Измерения заканчивают при абсорбции раствора, меньшей 0,1 отн.ед.
Таблица 1 - Выбор оптимальной концентрации катализатора
Объем катализатора CuSO4, см3 |
|||||
V1 |
V2 |
V3 |
|||
Время, мин |
Абсорбция, отн.ед. |
Время, мин |
Абсорбция, отн.ед |
Время, мин |
Абсорбция, отн.ед |
1 2 3 4 -- 20 |
|
|
|
|
|
Если время протекания реакции превышает 20 мин (при V1=0,8 см3), то необходимо приготовить второй стандартный раствор с большей концентрацией катализатора, если время – меньше, то соответственно следует уменьшить концентрацию катализатора.
5) Приготавливают поочередно серию стандартных растворов в мерных колбах вместимостью 50 см3, согласно таблице 2. Объем стандартного раствора катализатора следует взять по результатам таблицы 1. Растворы приготавливают поочередно, после добавления катализатора включают секундомер, затем доводят объем колбы дистиллированной водой до метки.
6) Заполняют кювету сначала первым стандартным раствором и проводят измерение абсорбции через каждую минуту относительно дистиллированной воды на выбранном светофильтре. Затем приготавливают и фотометрируют второй раствор, третий и т.д., результаты заносят в таблицу3.
Таблица 2 - Состав стандартных растворов
№ колбы |
Объем реактива, см3 |
|||
FeCl3 |
NH4СNS |
Na2 S2 О3 |
СuSO4 |
|
1 2 3 4 |
5 5 5 5 |
10 10 10 10 |
8 9 10 11 |
|
7) Получают анализируемый раствор тиосульфата натрия у лаборанта в мерную колбу вместимостью 50 см3 , добавляют те же реактивы, что и при приготовлении стандартных растворов, затем катализатор (одновременно включают секундомер), доводят дистиллированной водой до метки. Затем заполняют кювету анализируемым раствором и измеряют абсорбцию через каждую минуту (см. пункт 5). Результаты заносят в таблицу 3.
8) По окончании работы, выключают фотоколориметр, моют посуду, приводят рабочее место в порядок.
Расчет результатов анализа
1) Расчет концентрации приготовленных стандартных растворов тиосульфат-ионов
где Сисх.ст. р-ра. – концентрация исходного стандартного раствора тиосульфат-иона, моль/дм3; Сст. – концентрация, приготовленного раствора в колбе, моль/дм3; Vисх.ст.р-ра. – объем исходного стандартного раствора, дм3; Vк – объем колбы, дм3 .
2) Построение графиков в координатах -lgA – время (рисунок 1). Графики строятся по результатам эксперимента (таблица3).
Таблица 3 – Результаты эксперимента
Стандартные растворы, моль/дм3 |
Анализируемый раствор |
|||||||||||||
С1 |
С2 |
С3 |
С4 |
|||||||||||
, мин |
А |
-lgA |
, мин |
А |
-lgA |
, мин |
А |
-lgA |
, мин |
А |
-lgA |
, мин |
А |
-lgA |
1 2 3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
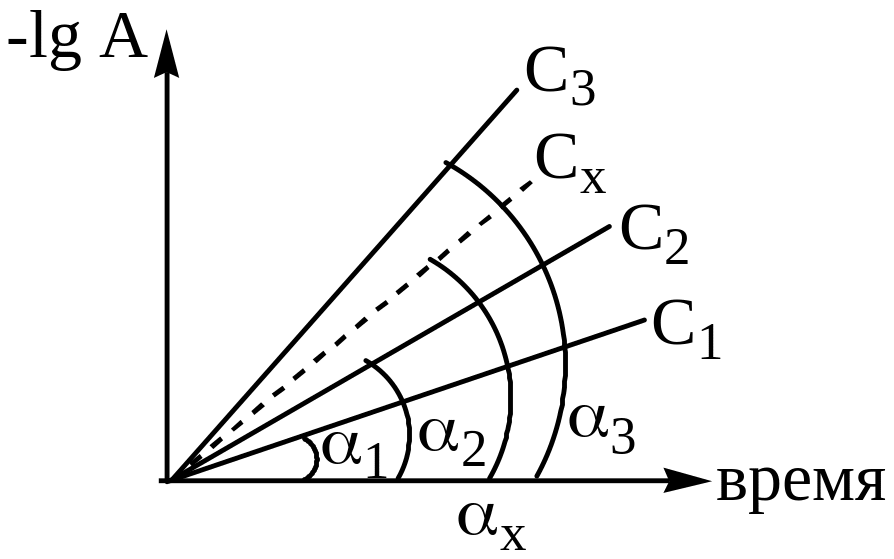
Рисунок 1 – Кинетические кривые для определения концентрации
