
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •Рекомендовано научно-методическим советом университета в качестве учебного пособия
- •© Ярославский государственный технический университет, 2006
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •1.4 Блок- схема установки монохроматора ум-2
- •1.5 Порядок титрования на ум-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Лабораторная работа № 2 анализ смеси красителей с непересекающимися спектрами на фотоколориметре кфк-2
- •Красителей в анализируемой смеси
- •Лабораторная работа № 3 анализ смеси красителей с пересекающимися спектрами на фотоколориметре кфк-2
- •Экстинкции анализируемых веществ
- •Лабораторная работа № 4 определение хрома дифенилкарбазидным методом
- •Лабораторная работа № 5 определение железа в виде трисульфосалицилата
- •Лабораторная работа № 6 определение меди методом дифференциальной фотометрии
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •Лабораторная работа № 7 фотометрическое титрование солей железа с сульфосалициловой кислотой
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование на фотоколориметре кфк-2»
- •Лабораторная работа № 8 фотометрическое титрование смеси протолитов на монохроматоре ум-2
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование смеси протолитов на монохроматоре ум-2»
- •2 Турбидиметрический метод анализа
- •Теоретические основы
- •Лабораторная работа № 9 турбидиметрический анализ сульфат-ионов
- •Вопросы к отчету по лабораторной работе «Турбидиметрический анализ сульфат-ионов»
- •3 Абсорбционная спектроскопия
- •3.2 Использование спектров поглощения для определения константы диссоциации кислотно-основных индикаторов
- •При различном положении равновесия
- •3.3 Блок-схема однолучевого спектрального прибора
- •3.4 Порядок работы на однолучевом спектрофотометре ум-2
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 10 запись спектров поглощения на однолучевом спектрофотометре
- •Анализ смеси невзаимодействующих красителей с пересекающимися спектрами на однолучевом спектрофотометре ум-2
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с пересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •Вопросы к отчету по работе
- •4 Инфракрасная спектроскопия
- •4.1 Теоретические основы
- •Связь с-н в метане
- •И деформационных колебаний
- •4.2 Расшифровка инфракрасных спектров
- •4.3 Блок-схема спектрометра мом-2000
- •4.4 Порядок включения и записи спектров на спектрометре мом-2000
- •Лабораторная работа № 14 идентификация органических соединений методом инфракрасной спектроскопии
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •6 Кинетические методы анализа
- •6.1 Теоретические основы
- •Скорость химической реакции зависит от следующих факторов:
- •В кинетических методах анализа используются различные методы определения концентрации. Среди них выделяют три основные группы методов:
- •По методу тангенсов:
- •По методу тангенсов
- •4) Используя градуировочный график, определяют концентрацию анализируемого вещества в пробе.
- •По методу фиксированного времени
- •Метод фиксированной концентрации
- •По методу фиксированной концентрации
- •По методу добавок
- •В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
- •Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSo4).
- •По методу тангенсов
- •Анализируемого вещества
- •Вопросы к отчету по лабораторной работе
- •Библиографический список
- •Оглавление
- •Учебное издание
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •План 2005
- •150023, Ярославль, Московский пр., 88
- •150028, Ярославль, ул. Советская, 14а
- •Ярославль 2006
3.2 Использование спектров поглощения для определения константы диссоциации кислотно-основных индикаторов
Кислотно-основные индикаторы по своей природе являются слабыми органическими кислотами или основаниями. Например, в водном растворе индикатора-кислоты НА согласно теории Бренстеда-Лоури устанавливается химическое равновесие (3.1).

(3.1)
Молекулярная (НА) и ионная (А-) формы индикатора имеют различную окраску, их полосы поглощения находятся в разных областях спектра.
Количественной характеристикой химического равновесия в разбавленных растворах (С 10-3 моль/дм3) служит константа кислотности (Ка)
 ,
(3.2)
,
(3.2)
где
,
![]()
- равновесная концентрация кислотной
и основной форм индикатора, соответственно.
После логарифмирования и изменения
знака, получаем формулы (3.3, 3.4):
- равновесная концентрация кислотной
и основной форм индикатора, соответственно.
После логарифмирования и изменения
знака, получаем формулы (3.3, 3.4):

или
 (3.3)
(3.3)
Из уравнения (3.3) видно, что изменение рН растворов вызывает изменение соотношения концентраций [HA] и [A-], следовательно, окраски и спектров поглощения растворов. Можно подобрать значения рН, при которых возможно сместить равновесие (1) либо в сторону молекулярной формы, либо в сторону ионной формы. В этом случае в спектре раствора обнаруживается только одна полоса поглощения, отвечающая молекулярной или ионной форме индикатора (рисунок 3.1, спектры 1, 6 соответственно). Для раствора с промежуточными значениями рН спектр поглощения более сложный, он включает одновременно полосы поглощения молекулярной и ионной форм индикатора.

Рисунок 3.1 – Спектр поглощения анализируемого красителя
При различном положении равновесия
Если записать спектры поглощения нескольких растворов индикатора (см. рисунок 3.1, спектры 2-5) со значениями рН, отвечающими интервалу перехода индикатора (химическому равновесию), то обнаруживается точка пересечения спектров, которая называется изобестическая точка (i). Следовательно, изобестическая точка на спектрах поглощения может служить признаком химического равновесия. Условием появления изобестической точки является равенство по модулю приращений абсорбций обоих форм индикатора, т.е. коэффициентов экстинкции молекулярной и ионной форм индикатора на =const:
Концентрации молекулярной НА и ионной форм рассчитывают по закону Ламберта-Бугера-Бера:
![]()
 (3.4)
(3.4)
Подставляя выражение для НА и из уравнения (3.4) в уравнение (3.3) получаем расчетную формулу для рК индикатора (3.5):
 ,
(3.5)
,
(3.5)
где А(НА), ( ), – абсорбция в максимумах полос поглощения кислотной (молекулярной), ионной (основной) форм индикатора соответственно; ( ), (НА) – молярные коэффициенты ослабления соответствующих форм, дм3 /моль·см, l – толщина кюветы, см.
Расчет (НА) и ( ) осуществляется по закону Ламберта-Бугера-Бера для растворов с известными концентрациями [HA] и [ ]. Значение (НА) – по спектру раствора, в котором присутствует только молекулярная форма (спектр 1), ( ) – по спектру раствора, в котором присутствует только ионная форма (спектр 6).
Величины рН растворов измеряют на рН-метрах или фиксируют, применяя буферные смеси. Буферные смеси подбирают с таким расчетом, чтобы значения рН находились внутри интервала перехода окраски индикатора (таблица 3.1).
Таблица 3.1 – Интервалы перехода окраски индикаторов
Индикатор |
Интервал перехода |
Индикатор |
Интервал перехода |
Метиловый оранжевый Бромфеноловый синий Конго-красный Ализариновый красный |
3,0-4,4 3,0-4,6 3,0-5,2 3,7-5,2 |
Метиловый красный Бромкрезоловый зеленый Лакмоид Бромкрезоловый пурпурный |
4,2-6,2 3,8-5,4 4,6-6,4 5,2-6,8 |
Чтобы увеличить точность определения рК, расчет выполняют не по одному измерению, а для серии растворов с различными значениями рН. Кроме того, для определения коэффициентов экстинкции следует приготовить два раствора со значениями рН, выходящими за пределы интервалов перехода на 1-3 единицы рН.
Результаты наносят на график, на котором прямая линия получается в осях рН – lg[HA]/[ ] (рисунок 3.2). В случае равенства концентраций основной и кислотной форм lg[HA]/[ ] = 0 и рК = рН.
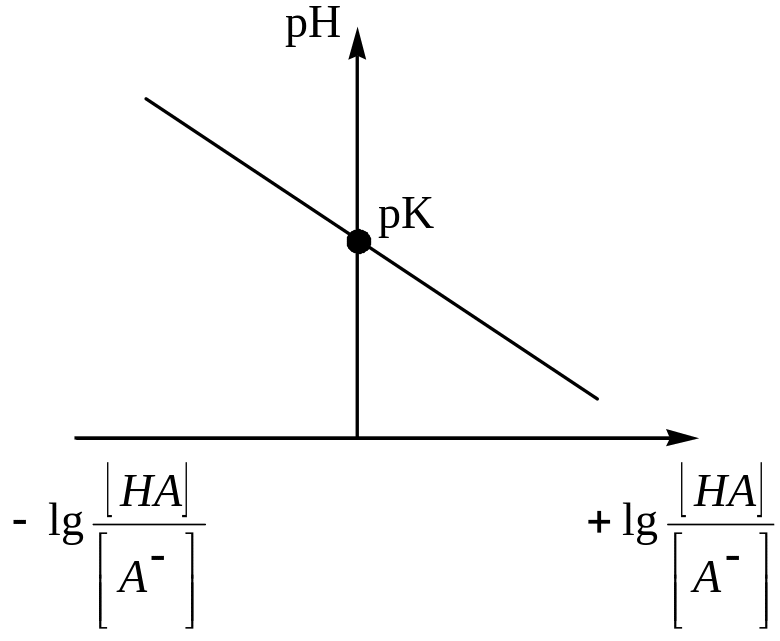
Рисунок 3.2 – График для определения рК
Таким образом, величина рК определяется по графику значением рН в точке пересечения прямой с ординатой.
