Лекція 4
ХІМІЧНИЙ ЗВ’ЯЗОК
При зближенні атомів виникає можливість утворення нових електронних структур, більш стабільних, чим електронні структури атомів. Це явище в хімії називається утворенням хімічного зв’язку і ми з вами розглянемо основи сучасних уявлень про його виникнення та властивості.
Хімічний зв’язок – це сила, що утримує разом два чи декілька атомів, іонів, молекул чи будь – яку комбінацію з них.
За своєю природою любий хімічний зв’язок можна розглядати, як електростатичну взаємодію між структурними одиницями, що його утворюють.
Типи хімічних зв’язків:
1) ковалентний;
2) іонний;
3) Металевий;
4) Водневий
В утворенні хімічних зв’язків приймають участь валентні електрони зовнішніх рівнів та ядра атомів. Величина сили притягання залежить від електронної конфігурації атомів. Наприклад, інертні гази досить важко утворюють хімічні зв’язки, тому що вони мають електронну конфігурацію зовнішнього рівня s2p6. На відміну від них, атоми елементів, що мають від одного до семи електронів, легко утворюють хімічні зв’язки.
Хімічний зв’язок, що утворений за рахунок пар електронів з протилежними спінами, що належать обом атомам, називають ковалентним. Пара елементів, що належить обом атомам називається узагальненою.
Розглянемо, як утворюється ковалентний зв’язок в молекулі водню, як самі простіші. Таку молекулу з точки зору хімічного зв’язку в ній розглядали Гейтлер та Лондон в 1927 році.
Коли два атоми гідрогену зближуються на досить малу відстань, вони притягаються один до одного.
·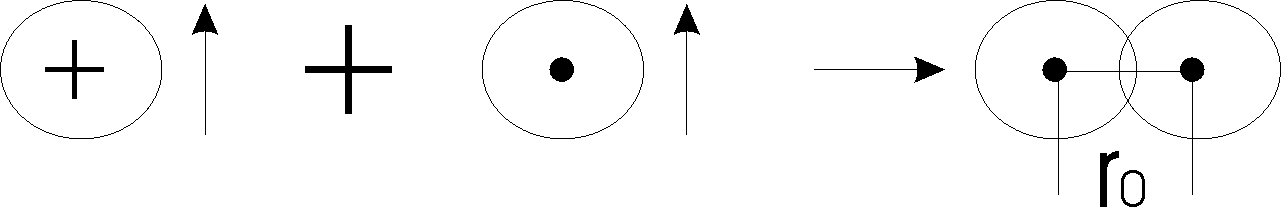
Але, якщо відстань між атомами буде дуже мала, то вони можуть і відштовхнутись, тому що відштовхуватись будуть або електрони, або ядра атомів. Таким чином треба, щоб відстань між атомами зрівнювали сили притягання та відштовхування.
Тепер розглянемо утворення хімічного зв’язку з точки зору зміни енергії атомів. Бо в період утворення зв’язку атоми повинні якось змінювати енергію. Якщо об'єднуютьсяться атоми з однаковими спінами електронів, то їх зближення приводить до збільшення енергії системи, тобто зв’язок утворюватись не буде. При протилежному направленні спінів електронів зближення атомів на відстань r0 приводить до зменшення енергії системи і при значенні r=r0 ця енергія стає min. На графіку вона має вигляд так званої “потенційної ями”
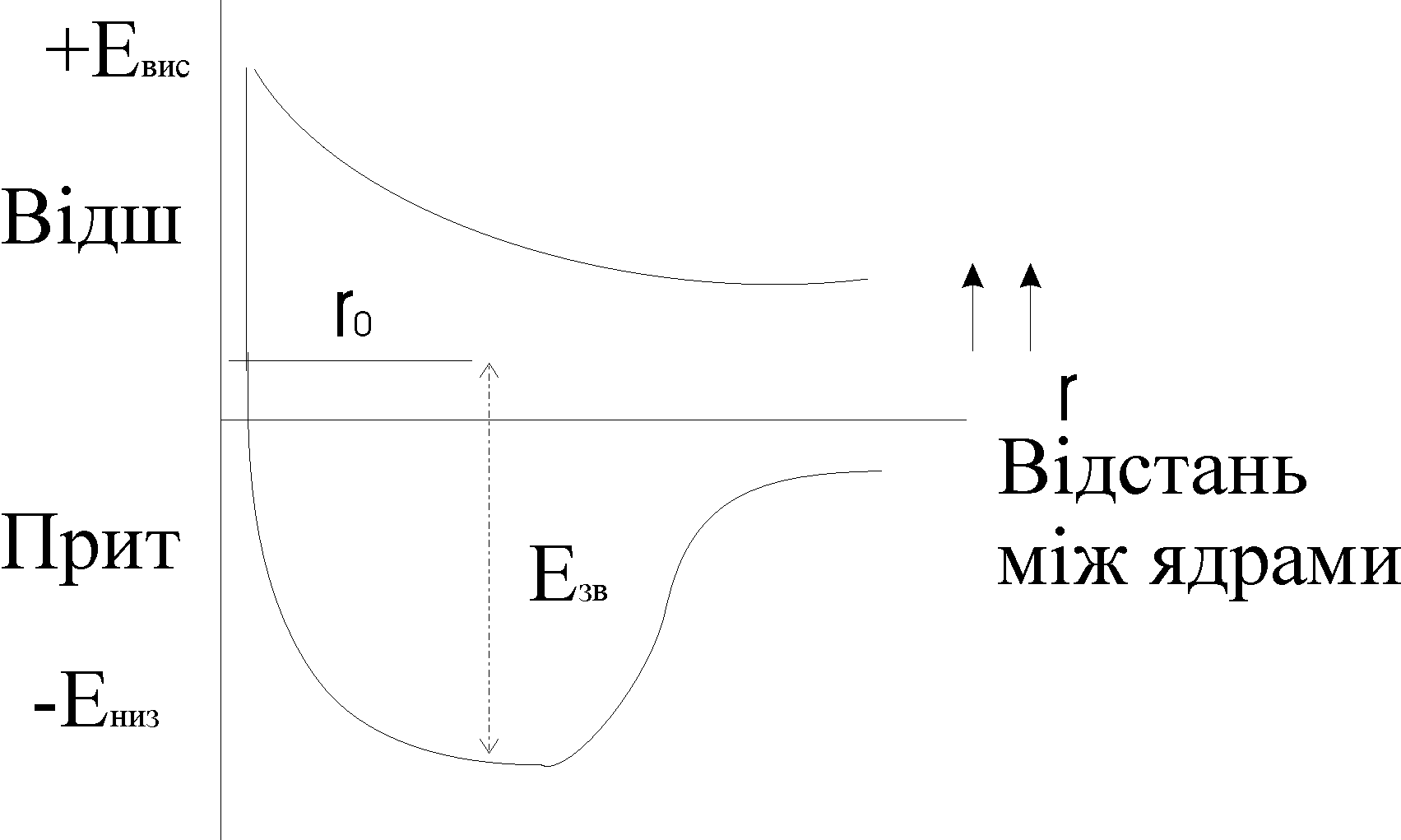


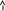

Якщо далі зближувати атоми то Е, тому що починають відштовхуватися ядра атомів. Таким чином, ковалентний зв’язок характеризується насамперед довжиною та енергією.
Довжина зв’язку – це така відстань між взаємодіючими атомами при якій сили відштовхування зрівноважені силами притягання, а потенційна енергія системи min.
Енергія зв’язку – це енергія яка необхідна для того, щоб роз’єднати два пов’язаних між собою атоми і віддалити їх на таку відстань, де вони не відчувають сили притягання один до одного.
Для утворення зв’язку необхідні таки чинники:
1) перетинання електронних хмар;
2) min потенційної енергії в системі;
3) антипаралельні спіни електронів.
Як вже казала раніше, в утворенні ковалентних зв’язків приймають участь лише зовнішні валентні електрони атомів. Таким чином, атоми набувають стійкої електронної конфігурації. Існує два механізми утворення ковалентних зв’язків:
1) обмінний;
донорно – акцепторний.
Поясніти їх дію можна за допомогою двох способів: метода молекулярних орбіталей або метода валентних зв’язків. Ми з вами розглянемо другий, тобто МВЗ.
Згідно МВЗ ковалентний зв’язок утворюється двома електронами з протилежно направленими спінами і ця пара електронів належить обом атомам. Чим більший ступінь перетинання взаємодіючих орбіталей, тим прочніший ковалентний зв’язок. Область перетинання електронних хмар – це область високої густини негативного заряду, який притягує позитивно заряджені ядра.
Приклад: перетинання електронних хмар для Н2 та Cl2 з урахуванням валентних електронів.
|
||
|
Н2 |
Сl2 |
|
|
|
Зв’язки в молекулах Н2 та Cl2 є простими одинарними зв’язками. Крім того такі зв’язки називають σ – зв’язками.
σ – зв’язок – це зв’язок при утворенні якого область перетинання електронних хмар знаходиться на лінії, що з’єднує ядра атомів.
Одинарні зв’язки завжди бувають тільки σ. Якщо в утворенні зв’язків приймає участь по два електрони кожного атома, то це вже будуть подвійні зв’язки. Наприклад:, молекула O2. А в молекулі N2 в утворенні зв’язку приймає участь 3 непарних електрони, тому це буде потрійний зв’язок. В таких кратних зв’язках утворюється завжди 1 σ - зв’язок та останні π – зв’язки.
π – зв’язок – це зв’язок, при утворенні якого область перетинання електронних хмар знаходиться по обидві сторони від лінії, що з’єднує ядра атомів.
В утворенні π – зв’язків приймають участь p та d – електрони, але не беруть участі s – електрони.
|
З-за орієнтації в просторі р – орбіталей з кутом 900 і хімічні зв’язки між р – орбіталями мають кути 900. Це валентні кути хімічного зв’язку. Валентні кути присутні в молекулах, що утворені багатоелектронними атомами. Такі молекули завжди мають просторове розташування, а між напрямками ковалентного зв’язку утворюються валентні кути.
Таким чином, ми розглянули ще дві характеристики ковалентного зв’язку: