
- •1.1. Истинная и средняя теплоемкости
- •1.2. Связь между массовой с, объемной с´ и мольной μс теплоемкостями
- •1.3. Элементы молекулярно-кинетической (мкт) и квантовой теории теплоемкости
- •1.3.1. Молекулярно-кинетическая теория
- •Изобарный процесс:
- •1.4. Показатель адиабаты и его зависимость от температуры
- •1.5. Теплоемкость газовых смесей
- •1.6. Элементы квантовой теории теплоемкости
- •2. Лабораторная установка
- •3. Порядок проведения работы
- •4. Обработка экспериментальных данных
- •Контрольные вопросы
Изобарный процесс:
Из уравнения Майера получим:
![]() ,
,
![]() ;
; ![]() .
.
Например,
для воздуха:
![]() кДж/(кг
· К)
кДж/(кг
· К)
Тогда для разных газов будем иметь
I
ат. газ (Ar):
i
= 3,
![]() кДж/(кмоль
· К)
кДж/(кмоль
· К)
II
ат. газ (N2):
i
= 5,
![]() кДж/(кмоль
· К)
кДж/(кмоль
· К)
III
ат. газ (CO2)
i
= 6,
![]() кДж/(кмоль
· К)
кДж/(кмоль
· К)
Следовательно, при одной и той же атомности газов μcv и μcp для разных газов - величины постоянные.
Например, для воздуха:
![]() кДж/(кг
· К)
кДж/(кг
· К)
Теплоемкость идеальных газов зависит только от молекулярной массы, температуры и характера процесса Теплоемкость реальных газов зависит также и от давления.
1.4. Показатель адиабаты и его зависимость от температуры
Показателем адиабаты является относительная теплоемкость
![]() .
.
Выразим показатель адиабаты через число степеней свободы
![]() ;
;
С учетом уравнения Майера формула принимает вид
![]() .
.
Из уравнения видно, что при R = const с увеличением температуры cv увеличивается, следовательно, показатель адиабаты k уменьшается.
1.5. Теплоемкость газовых смесей
Для газовых смесей массовая, объемная и мольная теплоемкости составляют:
![]() кДж/(кг
· К);
кДж/(кг
· К);
![]() кДж/(кг
· К);
кДж/(кг
· К);
![]() кДж/(м3
· К);
кДж/(м3
· К);
![]() кДж/(м3
· К);
кДж/(м3
· К);
![]() кДж/(кмоль
· К);
кДж/(кмоль
· К);
![]() кДж/(кмоль
· К).
кДж/(кмоль
· К).
Например, для воздуха:
![]()
![]() Дж/(кг
· К).
Дж/(кг
· К).
1.6. Элементы квантовой теории теплоемкости
Недостаток МКТ - эта теория учитывает только поступательное и вращательное движение молекул и не учитывает колебательные движения атомов в молекуле.
В соответствии с квантовой теорией теплоемкости энергия колебания атомов в молекулах учитывается, причем колебательная частота ω определяется опытным путем по спектроскопическим исследованием газа.
Колебания считают гармоническими. Тогда, например, мольная теплоемкость газов в идеальном состоянии может быть подсчитана по формуле:
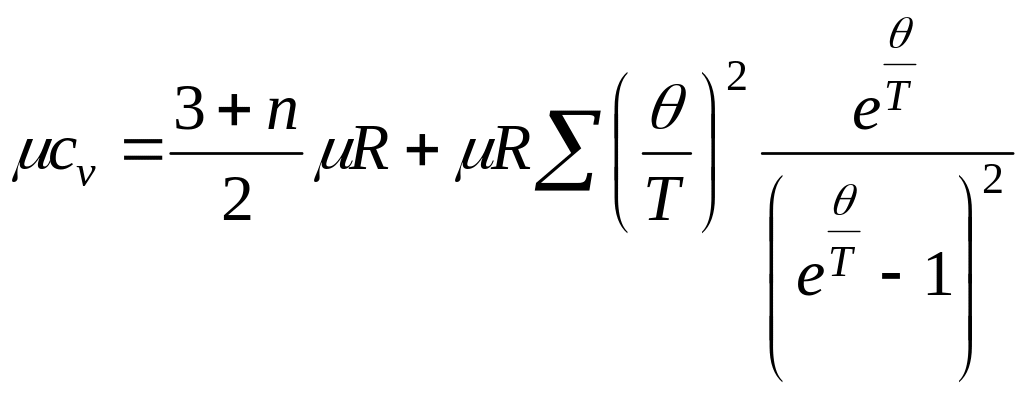 .
.
n - число вращательных степеней свободы; для двухатомных и многоатомных газов n = 2;
![]() ,
k
- характеристическая температура
(имеется в таблицах);
,
k
- характеристическая температура
(имеется в таблицах);
h = 6,62 · 10-34 Дж/с - постоянная Планка;
k = 1,38 · 10-23 Дж/К - постоянная Больцмана;
v ,1/с - частота колебаний;
μR, Дж/(кмоль · К) - универсальная газовая постоянная.
2. Лабораторная установка
Лабораторная установка состоит из калориметрической трубки 1, которая заключена в стеклянной оболочке 2. В трубке 1 расположена электрическая спираль 3. Воздух просасывается с помощью вентилятора 4, а его расход определяется с помощью газового счетчика 5.
Температура воздуха на входе t1 и выходе t2 из нагревательной системы фиксируется с помощью термометров 6, 7. Мощность электроспирали 3 регулируется реостатом 8, а измеряется вольтметром 9.

Рис. Схема лабораторной установки
3. Порядок проведения работы
3.1. Перед началом работы необходимо заполнить таблицу 1.
Таблица 1 - Характеристика измерительных приборов
№№ |
Наименование прибора |
Предел измерения |
Цена деления |
Класс точности |
|
|
|
|
|
3.2. Регулятором 7 установить минимальную мощность электронагревателя (примерного 50 Вт).
3.3. При достижении стационарного режима определить расход воздуха, проходящего через трубку калориметра 1.
3.4. Записать показания приборов в таблицу 2.
Таблица 2 - Параметры, которые измеряются во время опытов.
№ опыта |
N, Вт |
t1, °C |
t2, °C |
p, МПа |
Vн,
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
