
- •1.1. Истинная и средняя теплоемкости
- •1.2. Связь между массовой с, объемной с´ и мольной μс теплоемкостями
- •1.3. Элементы молекулярно-кинетической (мкт) и квантовой теории теплоемкости
- •1.3.1. Молекулярно-кинетическая теория
- •Изобарный процесс:
- •1.4. Показатель адиабаты и его зависимость от температуры
- •1.5. Теплоемкость газовых смесей
- •1.6. Элементы квантовой теории теплоемкости
- •2. Лабораторная установка
- •3. Порядок проведения работы
- •4. Обработка экспериментальных данных
- •Контрольные вопросы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ПРИАЗОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра теплофизики и теплоэнергетики металлургического производства
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению лабораторной работы № 30
“Определение средней теплоёмкости воздуха”
(специальность 6.090406 “Промышленная теплотехника”
очной и заочной форм обучения)
Мариуполь, 2008 г.
УДК 662.61+662.61(07)
Методические указания по выполнению лабораторной работы № 30 “Определение средней теплоёмкости воздуха” по курсу “Техническая термодинамика”. Для студентов специальности 6.090406 “Промышленная теплотехника” очной и заочной форм обучения.
Сост.: Куземко Р.Д., Мариуполь, ПГТУ, 2008, с 15
Приведены основные сведения о теплоёмкости идеального и реального газов, дано теоретическое введение, показана связь между различными видами теплоёмкости, излагается способ экспериментального определения средней теплоёмкости воздуха.
Приведены методы обработки полученных результатов.
Составитель, доц. Р.Д. Куземко
Отв. за выпуск зав. каф. ТТМП В.А. Маслов
Цель работы
Экспериментально определить значения средней теплоемкости воздуха в диапазоне изменения температур от t1 до t2, установить зависимость теплоемкости воздуха от температуры.
Содержание работы
Определить мощность, затрачиваемую на нагрев газа от t1
до t2.
Зафиксировать значения расхода воздуха в заданном интервале времени.
Рассчитать количество теплоты, которую воспринимает газ от нагревательной спирали.
Рассчитать величину средней массовой с объемной с´ и мольной μс теплоемкости, установить влияние температуры на теплоемкость.
Указания по подготовке к лабораторной работе
Проработать раздел курса “Теплоемкость” по рекомендуемой литературе.
Ознакомиться с настоящим методическим пособием.
Подготовить протоколы лабораторной работы, включив необходимый теоретический материал, относящийся к данной работе (расчетные формулы, схемы, графики).
1. Теоретическое введение
Теплоемкость - важнейшая теплофизическая величина, которая прямо или косвенно входит во все теплотехнические расчеты.
Теплоемкость характеризует теплофизические свойства вещества и зависит от молекулярной массы газа μ, температуры t, давления р, числа степеней свободы молекулы i, от процесса, в котором подводится или отводится теплота р = сопst, v = сопst. Наиболее существенно теплоемкость зависит от молекулярной массы газа μ. Так, например, теплоемкость для некоторых газов и твердых веществ составляет
Вещество |
Молекулярная масса, кг/кмоль |
Теплоёмкость, кДж/(кг К) |
Дерево |
12 |
2,4 |
Сталь |
56 |
0,5 |
Воздух |
28,97 |
1 |
Вода (р=0,1Мпа, t = 4оС) |
18 |
1,19 |
Вода (р=18Мпа, t =300оС) |
18 |
14 |
Водород, Н2 |
2 |
14 |
Таким образом, чем меньше μ, тем меньше вещества содержится в одном киломоле и тем больше нужно подвести теплоты, чтобы изменить температуру газа на 1 К. Вот почему водород является более эффективным охладителем, чем, например, воздух.
Численно теплоемкость определяется как количество теплоты, которое необходимо подвести к 1 кг (или 1 м3), вещества чтобы изменить его температуру на 1 К.
Так как количество подведенной теплоты dq зависит от характера процесса, то и теплоемкость так же зависит от характера процесса. Одна и та же система в разных термодинамических процессах обладает различными теплоемкостями - cp, cv, cn. Наибольшее практическое значение имеют cp и cv.
По молекулярно-кинематической теории газов (МКТ) для заданного процесса теплоемкость зависит только от молекулярной массы. Например, теплоемкость cp и cv можно определить как
![]() ;
; ![]() .
.
Для воздуха (k = 1,4; R = 0,287 кДж/(кг · К))
![]() кДж/кг
кДж/кг
Для заданного идеального газа теплоемкость зависит только от температуры, т.е.
![]() ;
; ![]() ;
; ![]() .
.
Теплоемкостью тела в данном процессе называется отношение теплоты dq, полученного телом при бесконечно малом изменении его состояния к изменению температуры тела на dt
![]() .
.
1.1. Истинная и средняя теплоемкости
Под истинной теплоемкостью рабочего тела понимают:
![]() .
.
Истинная теплоемкость выражает значение теплоемкости рабочего тела в точке при данных параметрах.
Количество передаваемой теплоты. выраженную через истинную теплоемкость, можно рассчитать по уравнению
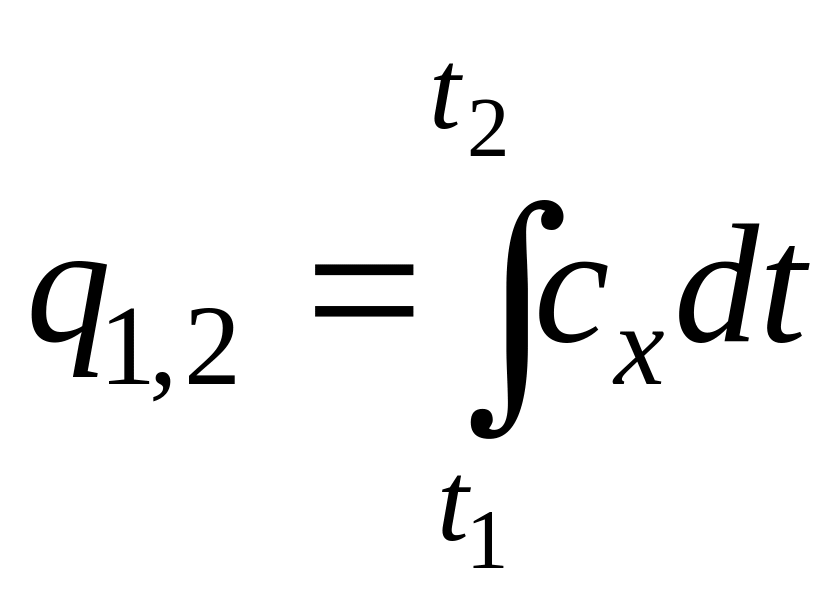 .
.
Различают:
- линейную зависимость теплоемкости от температуры
ГРАФИК!!
где а - теплоемкость при t = 0 °С;
b = tg α - угловой коэффициент.
- нелинейную зависимость теплоемкости от температуры.
ГРАФИК!!
Например, для кислорода уравнение представляется как
![]() кДж/(кг·К)
кДж/(кг·К)
Под средней теплоемкостью ст понимают отношение количества теплоты в процессе 1-2 к соответствующему изменению температуры
![]() кДж/(кг·К)
кДж/(кг·К)
ГРАФИК!!!
Средняя теплоемкость рассчитывается как:
![]() ;
;
![]() ,
где t
= t1
+ t2.
,
где t
= t1
+ t2.
Расчет теплоты по уравнению
![]()
затруднителен,
так как в таблицах дается значение
теплоемкости
![]() .
Поэтому теплоемкость в интервале от t1
до t2
необходимо определять по формуле
.
Поэтому теплоемкость в интервале от t1
до t2
необходимо определять по формуле
![]() .
.
Если температура t1 и t2 определяется экспериментально, то для m кг газа количество передаваемой теплоты следует рассчитывать по уравнению
![]() .
.
Средняя ст и с истинная теплоемкости связаны уравнением:
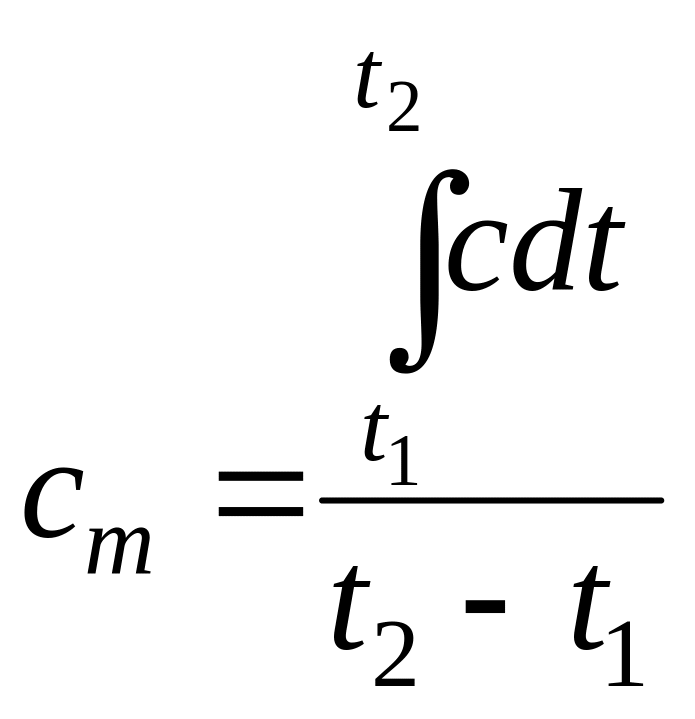 .
.
Для большинства газов чем больше температура t, тем выше теплоемкость сv, ср. Физически это означает, что чем больше нагрет газ, тем труднее нагревать его дальше.
1.2. Связь между массовой с, объемной с´ и мольной μс теплоемкостями
В
процессе подвода или отвода теплоты
теплоемкость могут относить к 1 кг,
1
![]() или 1 кмолю.
Поэтому различают
или 1 кмолю.
Поэтому различают
а) массовую теплоемкость
с, срт, cvm, cp, cv кДж/(кг · К);
б) объемную теплоемкость
с',
![]() ,
,
![]() ,
,
![]() ,
,
![]() кДж/(м3
· К);
кДж/(м3
· К);
в) мольную теплоемкость
μс, μср, μсv, μсрm, μсvm кДж/(кмоль · К).
Покажем связь между этими видами теплоемкости;
- между массовой и объемной
![]() ;
;
![]() кДж/(кг
· К);
кДж/(кг
· К);
![]() .
.
- между массовой и мольной
![]() ;
; ![]() кДж/(кг·К)
кДж/(кг·К)
- между объемной и мольной
![]() ;
; ![]() кДж/(кг·К)
кДж/(кг·К)
1.3. Элементы молекулярно-кинетической (мкт) и квантовой теории теплоемкости
1.3.1. Молекулярно-кинетическая теория
В соответствии с МКТ при хаотическом движении учитывается только поступательное и вращательное движение молекул, а остальными видами движения пренебрегают. Пространственное движение молекул раскладывается вдоль осей х, y, z. Считается, что внутренняя энергия равномерно распределяется вдоль х, у, z. В зависимости от количества атомов в молекуле число степеней свободы составляет
I ат. газ (Ar) - i = 3
II ат. газ (N2) - i = 5
III и более ат. газ (СО2) - i = 6
Покажем связь между с, u, R, μR, Т. После преобразования уравнения для расчета давления по МКТ, записанного для 1 м3.
![]() .
.
Легко получить, что
![]() ,
,
откуда
![]() .
.
Считают, что внутренняя энергия и распределяется равномерно по осям. Тогда для (i = 1) уравнение принимает вид:
![]() .
.
Для любого числа степеней свободы это уравнение принимает вид:
- для 1 кмоля
![]() кДж/(кг
· К);
кДж/(кг
· К);
-для 1 кг
![]() кДж/(кг
· К)
кДж/(кг
· К)
Установим связь между с, i и R для двух процессов: изохорного и изобарного.
Изохорный процесс:
Так как по первому закону термодинамики в изохорном процессе
![]() ,
при
,
при
![]() ,
,
![]() ,
то
,
то
![]() ,
,
![]() .
.
В зависимости от атомности газов μсv составляют
I
ат. газ (Ar):
i
= 3,
![]() кДж/(кг
· К)
кДж/(кг
· К)
II
ат. газ (N2):
i
= 5,
![]() кДж/(кг
· К)
кДж/(кг
· К)
III
ат. газ (СО2):
i
= 6,
![]() кДж/(кг
· К)
кДж/(кг
· К)
Тогда, например, для воздуха:
![]() кДж/(кг
· К)
кДж/(кг
· К)
