
3.2 Ионная связь
Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Она возможна только между атомами металлов и неметаллов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов. Например, образование ионов Na+ и Сl осуществляется путем перехода электрона от атома натрия к атому хлора.
Na0
(
1s2
2s2
2р6
3s1
)
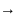 Na+
(
1s2
2s2
2p6
3s° )
Na+
(
1s2
2s2
2p6
3s° )
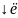
Cl0 (1s2 2s2 2p6 3s2 3p5 ) Сl (1s2 2s2 2p6 3s2 3p6 )
Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Ионная связь не обладает направленностью, поскольку каждый ион может притягивать к себе ионы противоположного знака по любому направлению. Не обладает насыщаемостью, т.к. взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность электростатически взаимодействовать с другими ионами.
Отсутствие у ионной связи направленности и насыщаемости обусловливает склонность ионных молекул к ассоциации, особенно при переходе в жидкое и твердое состояние. Все ионные соединения в твердом состоянии имеют ионную кристаллическую решетку.
Ионы могут быть простыми, т.е. состоящими из одного атома (например, катионы К+, Na+, анионы F- Сl- ) или сложными, состоящими из двух или более атомов (например, анионы S04 2-, N03-).
Способность атомов элементов образовывать простые ионы обусловлена их электронной структурой. При низких значениях энергии ионизации элемент образует катионы (s-элементы). Простые анионы легче образуют р-элементы 7 группы, имеющие большое сродство к электрону.
При присоединении электрона к атомам неметаллов выделяется энергия. Однако присоединение второго электрона требует затраты энергии, так что образование простых многозарядных анионов (02-,N3-) оказывается энергетически невыгодным. Например, при присоединении одного электрона к атому кислорода выделяется 1,47эВ энергии, а при присоединении второго электрона - поглощается 8,3 эВ. Поэтому в таких соединениях как оксиды (BaO, Al203 ) или сульфиды (CuS, ZnS) не образуется «чисто» ионная связь, химическая связь имеет частично ко-валентный характер. Вместе с тем, многозарядные сложные анионы (С032-, SO42-, PO4 3-) могут быть энергетически устойчивыми, поскольку избыточные электроны распределены между несколькими атомами, так что эффективный заряд каждого из атомов не превышает заряда электрона.
Следовательно, соединений с ионной связью немного. К типичным соединениям с ионным типом связи относятся галогениды щелочных металлов, например NaCl, KF . Но даже в типичных ионных соединениях не происходит полного разделения отрицательного и положительного зарядов, т.е. полного перехода электрона от одного атома к другому. Так, в кристалле NaCl заряды ионов Na+ и Сl- составляют только по 0,85 заряда электрона.
Для простоты вместо эффективных зарядов обычно указывают целочисленные заряды ионов, имея в виду, что именно такие ионы образуются при электролитической диссоциации ионного соединения в растворе или расплаве.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т.е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Каждый ион является источником электрического поля, поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга. Разные ионы под действием одного и того же электрического поля деформируются в разной степени, т.е. имеют разную поляризуемость. Поляризуемость ионов с одинаковыми зарядами, обладающих аналогичным строением внешнего электронного слоя, возрастает с увеличением размеров иона. Так, поляризуемость ионов щелочных металлов возрастает в ряду: Li+, Na+, K+, Rb+, Cs+ , а ионов галогенов в такой последовательности: F- Сl, Вг-, J- , что объясняется большим удалением внешних электронов от ядра и следовательно, они слабее удерживаются ядром.
Степень поляризации анионов, как правило, значительно выше степени поляризации катионов.
Поляризующая способность ионов (их способность оказывать деформирующее воздействие на другие ионы) также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле, поэтому наибольшей поляризующей способностью обладают многозарядные ионы. Поляризующая способность ионов одинакового заряда и аналогичного электронного строения уменьшается с увеличением ионного радиуса. В ряду катионов щелочных металлов поляризующая способность падает от лития к цезию.
Радиусы анионов больше радиусов катионов, вследствие этого анионы обладают меньшей поляризующей способностью, чем катионы.
Таким образом, анионы по сравнению с катионами характеризуются сильной поляризуемостью и слабой поляризующей способностью. Поэтому при взаимодействии разноименных ионов поляризации подвергается в основном анион, поляризацией катиона можно пренебречь.
В результате поляризующего действия катиона электронные облака катиона и аниона разделяются не полностью, а частично перекрываются, за счет смещения электронного облака аниона. Происходит как бы обратный перенос части электронной плотности от аниона к катиону. Поэтому связь между атомами из чисто ионной превращается в сильно полярную ковалентную связь. Этим и объясняется что заряды атомов в ионных соединениях оказываются меньшими, чем заряд электрона.
Чисто
ионная связь есть предельный случай
ковалентной полярной связи. Если степень
ковалентности связи мала по сравнению
со степенью ее ионности, то такая
связь считается ионной. По Полингу
химической
связи с 50%-ной ионностью отвечает разность
электроотрицательностей (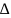 ЭО)
равная 1,7. При больших различиях в
значениях ЭО атомов, связь,
преимущественно, ионная. Например:
CsCl,
ВаСl2,
MgCl2,
AlCl3,
SnCl2,
BiCl3
ЭО)
равная 1,7. При больших различиях в
значениях ЭО атомов, связь,
преимущественно, ионная. Например:
CsCl,
ВаСl2,
MgCl2,
AlCl3,
SnCl2,
BiCl3
ЭО= 2,3 2,1 1,8 1,5 1,2 1,1
Очевидно, что CsCl, ВаСl2, MgCl2 - ионные соединения, остальные хлориды - ковалентные.
