
- •Развитие теплофизики и атомистики в XIX веке.
- •Опыты Румфорда
- •Развитие теории мкт в хiх веке.
- •Открытие внешнего фотоэффекта
- •Открытие внешнего фотоэффекта
- •Разработка метода спектрального анализа
- •Создание периодической системы элементов
- •Спектральные серии атома водорода
- •Открытие рентгеновских лучей
- •Открытие электрона
- •Открытие радиоактивности
- •Открытие зависимости массы электрона от скорости
- •Электромагнитная теория материи
- •Исследования природы
Развитие теории мкт в хiх веке.
Во второй половине XIX столетия продолжала развиваться молекулярно-кинетическая теория. Еще в 1848 году в докладе «Некоторые замечания о теплоте и о строении упругих жидкостей», сделанном на заседании Манчестерского литературного и философского общества, Джоуль излагает свой вывод о том, что теплота есть форма «живой силы» (кинетической энергии) частиц. Упоминая о своих опытах 1844 года по изменению температуры воздуха при адиабатическом сжатии или расширении, он заключает, что упругость газов «должна представлять собой эффект движения частиц, из которых состоит всякий газ».
Джоуль ссылается на высказывание Хэмфри Дэви, что теплота есть колебательное движение частиц вещества, указывает, что и вращательное движение молекул способно объяснить многие свойства газов (Джоулю неизвестен тот факт, что М.В.Ломоносов еще в 1743-1745 гг. объяснял закон Бойля с помощью гипотезы о вращательном движении молекул). Однако он считает более простой и убедительной гипотезу, предложенную в 1821 году английским физиком Джоном Герапатом, согласно которой частицы газа представляют собой упругие шары, постоянно движущиеся поступательно с большими скоростями во всех направлениях по отрезкам прямых и сталкивающиеся друг с другом и со стенками сосуда (модель идеального газа).
На конкретном примере водорода Джоуль произвел подсчет скорости движения молекул газа и установил ее зависимость от температуры. Считая давление газа результатом ударов молекул о стенки сосуда, он установил, что «абсолютная температура, давление и vis viva (живая сила) пропорциональны друг другу», при этом «давление будет пропорционально квадрату скорости частиц», а теплоемкость газа «выражается общей суммой vis viva при данной температуре». Таким образом, на основе конкретного числового подсчета Джоуль фактически вывел основное уравнение состояния идеального газа.
В 1857 году в «Анналах физики» Поггендорфа была опубликована статья Клаузиуса «О роде движения, который мы называем теплотой», в которой автор развивал основные положения молекулярно-кинетической теории газов. К этой же теме Клаузиус обращался позже в своей «Механической теории тепла».
Клаузиус отмечает, что его термодинамические исследования не связаны с какими-либо представлениями о тепловом движении. Действительно, термодинамические методы являются наиболее общими методами; поэтому термодинамика не нуждается в специальной гипотезе о природе теплоты. Однако Клаузиус признается, что его термодинамические исследования «не были свободны от мысли о некоторой гипотезе» и что он «уже в начале своих работ, относящихся к теплоте, … пытался разобраться во внутреннем состоянии движения нагретого тела …». Он излагает основные представления новой теории газов, которую он называет «кинетической».
Согласно этим представлениям, молекулы газа находятся в состоянии непрерывного движения; они движутся прямолинейно с постоянной скоростью, которая изменяется по величине и по направлению лишь в процессах столкновения с другими молекулами или с непроницаемой стенкой. При этом Клаузиус утверждает, что, несмотря на то, что скорости отдельных молекул изменяются в процессах столкновения, «живая сила (кинетическая энергия) их движений в среднем сохраняет ту же величину, какую она имела до столкновения». Давление газа Клаузиус объясняет ударами молекул о стенку сосуда. Наконец, наряду с поступательным движением молекул Клаузиус допускает и вращательное, а также колебательное движение внутри отдельных молекул. Более того, Клаузиус допускает, что и составляющие молекулу атомы могут иметь некоторую внутреннюю структуру, которой также присущи те или иные формы движения.
Наличие этих внутренних степеней свободы приводит к тому, что отдельные молекулы между собой и со стенкой взаимодействуют неупруго. Но, по Клаузиусу, для большого числа молекул в среднем результат соударений оказывается таким же, как если бы молекулы отражались от стенки «согласно тем же законам, что и упругие шары от неподвижной стенки».
Итак, в выводах Клаузиуса сделано важное упрощение: удары молекул о стенку считаются упругими. В действительности же это предположение, как ни удивительно, является несущественным. Это свойство – независимость результата от закона отражения – есть следствие теплового равновесия между газом и стенками сосуда. После установления теплового равновесия можно не принимать во внимание соударений молекул между собой (т.к. их распределение по скоростям от этого не изменяется), а соударения молекул со стенкой считать упругими. От того, каким именно образом молекулы отражаются от стенки, окончательный результат – тепловое равновесие – не изменяется.
Это важное свойство теплового равновесия можно проиллюстрировать следующим примером. Пусть в сосуде с газом поставлена легкая подвижная перегородка, которая разделяет газ на две части так, что плотность газа и его температура в обеих частях сосуда одинаковы. Предположим, что одна сторона перегородки полированная, а другая шероховатая, так что законы отражения молекул от перегородки с обеих сторон заведомо различны. Если бы давления на перегородку с противоположных сторон оказались также различными, она бы передвинулась так, чтобы выравнять давления. Тем самым, оказалось бы, что в равновесии плотности газа с разных сторон перегородки различаются, хотя давления и температуры в обеих частях сосуда одинаковы. Но этот вывод находится в противоречии с уравнением газового состояния: давление и температура однозначно определяют плотность газа. Значит, давление не может зависеть от закона отражения молекул газа от стенок.
Предполагая, что молекулы газа «движутся во всех возможных направлениях, так что любое направление столь же вероятно, как и все прочие», и применяя к актам упругого столкновения молекул со стенками законы классической механики Ньютона, Клаузиус получил основную формулу молекулярно-кинетической теории газов, согласно которой давление газа равно двум третям средней кинетической энергии всех молекул в единице объема
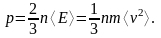 (12.11)
(12.11)
В 1859 году на собрании Британской Ассоциации содействия прогрессу наук Джеймс Кларк Максвелл выступил с докладом «Пояснения к динамической теории газов». Он сообщил о своем открытии формулы распределения молекул газа по скоростям. Для того времени его вывод казался очень странным. Максвелл не решал подробно уравнений для каждого из сталкивающихся атомов, а сразу получил условия для равновесного состояния системы из большого числа молекул.
Попытки детально изучить движение молекул газа предпринимались и до Максвелла. Но до Максвелла для упрощения математических выкладок полагали, что молекулы газа движутся по трем взаимно перпендикулярным направлениям с одинаковой скоростью (немецкий физик Август Карл Крениг) или с одной и той же средней скоростью, но без взаимных столкновений (Р.Клаузиус). Правда, в ответ на критику Клаузиус ввел понятие средней длины свободного пробега молекулы, но при вычислении этой величины он исходил из самых простых предположений: идеальный газ состоял из неподвижных равномерно распределенных молекул, а с постоянной средней скоростью двигалась только одна молекула.
Все эти допущения Максвелл отверг как нереальные и предложил свой закон распределения газовых молекул. По Максвеллу, столкновения молекул газа друг с другом каждый раз придают им различные скорости. В случае газа, находящегося в состоянии теплового равновесия, его молекулы распределены по скоростям группами. Невозможно вычислить скорость отдельной молекулы газа, но можно вычислить скорость группы молекул. Как это сделать?
Основываясь
на положениях теории вероятностей,
Максвелл ввел в молекулярно-кинетическую
теорию статистический метод. Рассматривая
изменения проекций
 скорости каждой молекулы в результате
столкновений, как статистически
независимые, он пришел к выводу, что
проекции скорости молекулы являются
случайными величинами, распределенными
согласно нормальному (гауссову)
распределению. Эту мысль Максвелл
выразил словами: «…скорости распределяются
между частицами по тому же закону, по
которому распределяются ошибки между
наблюдениями в теории метода наименьших
квадратов». Таким образом, Максвелл
получил, что число молекул, проекция
скорости которых на определенное
направление лежит в интервале между vx
и vx+ dvx
,
равно
скорости каждой молекулы в результате
столкновений, как статистически
независимые, он пришел к выводу, что
проекции скорости молекулы являются
случайными величинами, распределенными
согласно нормальному (гауссову)
распределению. Эту мысль Максвелл
выразил словами: «…скорости распределяются
между частицами по тому же закону, по
которому распределяются ошибки между
наблюдениями в теории метода наименьших
квадратов». Таким образом, Максвелл
получил, что число молекул, проекция
скорости которых на определенное
направление лежит в интервале между vx
и vx+ dvx
,
равно
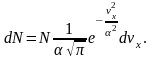 (12.12)
(12.12)
Отсюда следовало, что число молекул, модули скорости которых лежат в интервале от v до v + dv , равно
 (12.13)
(12.13)
Сегодня мы записываем эту формулу в виде
 (12.14)
(12.14)
В
1859 году соотношение
 еще не было известно; в частности,
постоянная Больцмана k
была введена лишь в 1899 году Максом
Планком. Поэтому Максвелл ввел в свои
формулы некоторую постоянную ,
которую выразил через среднее значение
квадрата скорости с помощью соотношения
еще не было известно; в частности,
постоянная Больцмана k
была введена лишь в 1899 году Максом
Планком. Поэтому Максвелл ввел в свои
формулы некоторую постоянную ,
которую выразил через среднее значение
квадрата скорости с помощью соотношения
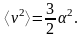
Вопрос о длине свободного пробега молекул газа он рассмотрел, основываясь на предположении, что их скорость не равна некоторой средней, а распределена согласно найденному им закону, что явилось важным этапом в развитии кинетической теории газов.
Макс Планк позже говорил: «Максвелл … поставил вопрос о величине скорости отдельной, произвольно взятой молекулы, и ответ на этот вопрос стал основой новой отрасли науки – статистической физики».
Однако в то время не могли экспериментально доказать правильность подобных выводов, да и представления о молекулах и законах их движения были весьма гипотетическими. Не удивительно, что Уильям Томсон пытался даже проверить закон распределения, рассматривая механику биллиардных шаров. В дальнейшем биллиард оказался популярной моделью для исследования поведения коллектива атомов, и теория сталкивающихся шаров на биллиардных столах различной формы развилась в интересную область математики.
А Максвелл вновь вернулся к выводу своей формулы в 1866 году. Он исследовал механические модели соударений, в которых молекулы представлялись, как упругие тела конечных размеров (что не расходилось с общепринятыми тогда положениями), и в своей «Динамической теории газов» показал, что полученное им ранее распределение действительно не изменяется при соударениях молекул.
