- •Кардиоселективные бета-блокаторы, артериальная гипертония и ожирение в практике врача первичного звена
- •Антиаритмические препараты
- •Антиаритмические препараты
- •Антиаритмические препараты
- •Сектраль (sectral, польша)
- •Амлодипин
- •Лечение больных с желудочковыми аритмиями
- •Антиаритмические средства
- •Антиаритмические средства
- •Классификация антагонистов кальция по химической структуре:
Антиаритмические средства
Для лечения нарушений ритма сердца применяют антиаритмические средства.
Для устранения эктопических нарушений ритма сердца антиаритмические средства должны оказывать определенное воздействие на электрофизиологические свойства клеток миокарда, осуществляемое различными путями:
1. Замедлением скорости потенциала действия, способствующим замедлению проведения возбуждения. Такое влияние оказывают в терапевтических дозах хинидин, новокаинамид и аймалин. "Чистые" бета-адреноблокаторы и амиодарон не влияют на скорость нарастания потенциала действия.
2. Снижением возбудимости миокарда. Этим свойством обладают большинство антиаритмических средств и сердечные гликозиды.
3. Удлинением времени эффективной рефрактерности, что имеет значение для устранения импульсов, возникающих через слишком малый интервал после нормального сокращения, а также при тахикардиях. Период эффективной рефрактерности удлиняется под влиянием хинидина, новокаинамида.
4. Сокращением периода относительной рефрактерности, которое наступает под влиянием ксикаина (лидокаина) и дифенина, приводит к укорочению интервала, при котором внеочередной импульс может вызвать сокращения сердца.
5. Угнетением очагов эктопического автоматизма, которое связано с удлинением времени диастолической деполяризации. Этим свойством в наибольшей степени обладают аймалин, хинидин и новокаинамид, в меньшей - дифинин.
6. Увеличением скорости проведения возбуждения, что может способствовать гомогенизации проведения возбуждения и препятствовать феномену "повторного входа" (re-entre). Таков механизм действия изадрина.
7. Устранением различия в скорости проведения возбуждения и показателях рефрактерности соседних волокон (устранение феномена "повторного входа"). Такой эффект дают бета-адреноблокаторы.
8. Угнетением следовых потенциалов, что, по-видимому, оказало бы существенное влияние на нарушения ритма сердца.
9. Снижением чувствительности сердца к электрическому разряду и уменьшение опасности возникновения фибрилляции желудочков.
В настоящее время считается, что аритмии возникают либо вследствие нарушений процессов импульсообразования, либо в результате нарушений распространения возбуждения по сердцу, либо, наконец, вследствие сочетания обоих механизмов. В связи с этим об эффективности различных антиаритмических препаратов судят по их влиянию на один из перечисленных механизмов развития аритмий и связанные с ними трансмембранные ионные токи.
В зависимости от механизма действия все применяемые в клинике собственно антиаритмические средства делят на несколько классов:
I класс - вещества с прямым блокирующим действием на мембрану - мембраностабилизирующие средства, который подразделяется на подклассы IА; IВ; IС;
II класс - блокаторы бета-адренорецепторов;
III класс - блокаторы кальциевых каналов.
К этим классам необходимо добавить следующие средства: воздействующие на электролиты, сердечные гликозиды, адреномиметические и холинолитические вещества.
Класс I включает наибольшее количество антиаритмических препаратов, обладающих местным анестезирующим действием различной степени выраженности. В меньших концентрациях, необходимых для выявления антиаритмического действия, они оказывают влияние на электрофизиологические характеристики волокон миокарда. Основным свойством этих препаратов является их способность уменьшать максимальную скорость деполяризации клетки миокарда в результате антагонистического взаимодействия с быстрыми натриевыми каналами мембраны клетки. В терапевтических концентрациях указанное действие ассоциируется с увеличением порога возбудимости, угнетением проводимости и увеличением эффективного рефрактерного изменения как потенциала покоя мембраны клетки, так и продолжительности потенциала действия, но неизменно регистрируется подавление спонтанной диастолической деполяризации клеток проводящей системы сердца.
Препараты данного класса обеспечивают терапевтический эффект у больных с аритмиями, возникающими в результате циркуляции волны возбуждения по замкнутому кругу, путем изменения эффективного рефрактерного периода, а у больных с аритмиями, в основе которых лежит механизм усиления автоматии или уменьшения порога возбудимости, путем подавления спонтанной диастолической деполяризации.
К классу IА относятся следующие препараты:
Аймалин (гилуритмал) - антиаритмический препарат, алкалоид раувольфии змеевидной. Вызывает снижение возбудимости миокарда, замедление атрио-вентрикулярной и внутрижелудочковой производимости, подавление автоматии синусового узла. Не оказывает выраженного влияния на сократимость миокарда и артериальное давление, хотя в отдельных случаях может вызвать снижение артериального давления. Назначается для лечения и профилактики пароксизмальной наджелудочковой тахикардии, пароксизмальной желудочковой тахикардии, пароксизмов мерцания и трепетания предсердий, наджелудочковой и желудочковой экстрасистолии. Режим дозирования. Выпускается в драже, растворе для внутривенного и внутримышечного введения. Взрослым вводят внутривенно в дозе 50 мг в течение 2-4 мин. Внутримышечно вводят в дозе 50 мг через каждые 3-4 часа. Средняя суточная доза 150-300 мг на 4-6 приемов.
Ритмилен (корапейс, ритмодан). Режим дозирования. Выпускается в капсулах. Назначается по 1 капсуле 3-4 раза в сутки.
Нео-гилуритмал. Режим дозирования. Выпускается в таблетках, назначается по 1 табл. 3-4 раза в сутки.
Новокаинамид. Режим дозирования. Выпускается в таблетках и в растворе для инъекций. Назначается по 1-2 таблетки 3-4 раза в сутки. В/м и в/в - индивидуальных дозах.
Кинидин дурулес (хинидин). Режим дозирования. Выпускется в таблетках. Назначается 2-5 табл. утром и вечером, поддерживающая доза - 3 табл. утром и вечером.
Пульснорма. Режим дозирования. Выпускается в драже. Назначается по 2 драже 3-4 раза в сутки. Поддерживающая доза - по 1 драже 3-4 раза в сутки.
К классу IВ относятся следующие препараты:
Лидокаин. Он является активным местноанестезирующим и антиаритмическим средством. Вызывает все виды местной анестезии. Стабилизирует клеточные мембраны, блокирует натриевые каналы, в миокарде подавляет автоматию эктопических очагов, главным образом в желудочках; практически не угнетает проводимость и сократимость миокарда. Способствует выходу ионов калия из клеток миокарда и ускоряет процесс реполяризации клеточных мембран, укорачивает продолжительность потенциала действия и эффективного рефрактерного периода. Назначается для лечения и профилактики желудочковых нарушений сердечного ритма. Режим дозирования. Выпускается в растворе для в/в и в/м инъекций. Назначение дозы индивидуально.
Риталмекс (мекситил). Режим дозирования. Выпускается в капсулах. Назначается по схеме: в первый прием - 400-600 мг, затем каждые 6 часов по 200 мг. В последующие дни (2-й и дальше) по 200 мг каждые 8 часов.
К классу IС относятся следующие препараты:
Аллапинин. Антиаритмический препарат, блокирующий натриевые каналы мембран кардиомиоцитов. Укорачивает рефрактерный период предсердий и желудочков или изменяет его. Замедляет проведение возбуждения по предсердиям, пучку Гиса, волокнам Пуркинье. Не угнетает функции автоматизма синусового узла, не оказывает отрицательного ионотропного действия на миокард, не изменяет системное артериальное давление. Назначается для лечения наджелудочковой и желудочковой экстрасистолии, пароксизмов мерцания и трепетания предсердий, пароксизмальной наджелудочковой тахикардии, пароксизмальной желудочковой тахикардии для лечения аритмии при инфаркте миокарда. Режим дозирования. Выпускается в таблетках, в растворе для инъекций. Назначается за 30 минen до еды через каждые 8 часов по 25 мг. Возможно увеличение дозы до 50 мг каждые 8 часов. Парентеральное лечение назначается индивидуально.
Этацизин. Режим дозирования. Выпускается в таблетках. Назначается по 1 табл. 3 раза в сутки.
Этмозин. Режим дозирования. Выпускается в таблетках. Назначается по 1 табл. 3-4 раза в сутки.
Ритмонорм. Режим дозирования. Выпускается в таблетках, в растворе для инъекций. Назначается индивидуально.
Класс II - это группа антиаритмических препаратов, включающих в себя пропранолол и другие бета-блокаторы, оказывающие антиаритмическое действие в основном благодаря блокаде симпатической стимуляции, которая осуществляется через бета-рецепторы. Блокаторы бета-адренорецепторов, подавляя активность аденилатциклазы клеточной мембраны, тормозят образование цАМФ, которая является внутриклеточным передатчиком действия катехоламинов.
В терапевтических концентрациях, не оказывающих прямого действия на мембрану клетки здорового миокарда, бета-адреноблокаторы не влияют на трансмембранный потенциал, максимальную скорость деполяризации волокон миокарда предсердий, желудочков и волокон Пуркинье.
Блокаторы бета-адренорецепторов предупреждают усиление спонтанной диастолической деполяризации, вызываемой катехоламинами. Поэтому под влиянием этих препаратов происходит уменьшение частоты синусовых импульсов и устранение эктопических импульсов, в основе которых лежит указанный механизм действия. Бета-адреноблокаторы увеличивают эффективный рефрактерный период предсердий, функциональный и эффективный рефрактерные периоды предсердно-желудочкового узла. Однако при этом существенно не изменяется проводимость и рефрактерность специализированной проводящей системы Гиса - Пуркинье и дополнительных трактов.
Бета-адреноблокаторы обладают отрицательным ионотропным действием и уменьшают сердечный выброс, потребление миокардом кислорода, коронарный кровоток, при этом периферическое сопротивление увеличивается. Продолжительность ионотропного действия меньше, чем хронотропного.
Бета-адреноблокаторы различаются по избирательности действия на бета-1- и бета-2-адренорецепторы. В связи с этим препараты, блокирующие оба вида рецепторов, называются некардиоселективные, а препараты, блокирующие бета-1-адренорецепторы, относятся к кардиоселективным.
Пропранолол (анаприлин, индерал, обзидан) - неселективный бета-адреноблокатор. Обладает антиангинальным, гипотензивным и антиаритмическим эффектами. Уменьшает автоматию синусового узла, урежает число сердечных сокращений, замедляет атриовентрикулярную проводимость, снижает сократимость миокарда, снижает потребность миокарда в кислороде. Снижает возбудимость миокарда, уменьшает возникновение эктопических очагов, оказывает мембраностабилизирующее действие. Оказывает гипотензивное действие. Назначается при наджелудочковой форме аритмии, мерцании и трепетании предсердий, желудочковой экстрасистолии. Режим дозирования. Препарат выпускается в таблетках, капсулах, растворе для инъекций. Назначается по 10-40 мг 1-3 раза в сутки. Парентеральное лечение назначается индивидуально.
Коргард. Режим дозирования. Выпускается в таблетках. Назначается по 20-80 мг 1-2 раза в сутки.
Соталол (соталекс). Режим дозирования. Выпускается в таблетках. Назначается по 20-80 мг мг 1-2 раза в сутки.
Атенолол (атенова, атенобене, бетакард, тенормин, хайпотен) - селективный бета-адреноблокатор. Сохраняет свойства бета-адреноблокаторов. Не обладает внутренней симпатометической и мембраностабилизирующей активностью. Не вызывает спазм бронхов. Назначается для лечения и профилактики наджелудочковых форм аритмии, тахикардии синусовой, желудочковой экстрасистолии. Режим дозирования. Выпускается в таблетках. Назначается по 25-100 мг 1-3 раза в сутки.
Особенностью электрофизиологического действия препаратов класса III является значительное увеличение продолжительности потенциала действия миокардиальных клеток. Эти препараты не обладают местным анестезирующим действием и обладают крайне слабо выраженными свойствами, присущими II классу антиаритмических препаратов.
Амиодарон (кордарон, опакордэн, седакорон) - противоаритмическое и антиангинальное средство. Увеличивает продолжительность потенциала действия и эффективный рефрактерный период кардиомиоцитов во всех отделах сердца. Уменьшает автоматию синусового узла, урежает число сердечных сокращений, замедляет атриовентрикулярную проводимость, снижает возбудимость миокарда. Назначается для лечения и профилактики наджелудочковых и желудочковых форм аритмии. Режим дозирования. Выпускается в таблетках и в растворе для инъекций. Внутрь назначается по 100-200 мг по схеме. Парентеральное лечение индивидуально.
К классу IV относятся препараты, являющиеся ингибиторами переноса ионов кальция, - блокаторы кальциевых каналов.
Верапамил (изоптин, лекоптин, фаликард) - антиаритмическое, антиангинальное, гипотензивное средство. Уменьшает частоту и силу сердечных сокращений, замедляет атриовенрикулярную проводимость. Уменьшает потребность миокарда в кислороде. Вызывает расширение коронарных артерий и увеличение коронарного кровотока, понижает тонус периферических артерий. Назначается для лечения и профилактики наджелудочковых форм аритмии. Режим дозирования. Выпускается в таблетках и растворе для инъекций. Внутрь назначается по 40-80 мг 1-3 раза в сутки. Парентеральное лечение индивидуально.
Среди препаратов других групп, применяемых при нарушениях ритма, чаще всего используются препараты, содержащие ионы калия и магния: панангин, аспаркам, калий-нормин, а также сердечные гликозиды в индивидуальных дозах при лечении наджелудочковых форм аритмии.
В последние годы для купирования пароксизмальных наджелудочковых тахикардий применяют препарат, улучшающий метаболизм миокарда: аденозинфосфат, аденокор.
Источник: Энциклопедия традиционной
ВПЕРВЫЕ В МИРЕ - в РОССИИ ! ДЕЛЬТАРАН ПРЕПАРАТЫ НОВОГО КЛАССА - НЕЙРОПРОТЕКТОРЫ ДЛЯ ЭКСТРЕМАЛЬНОЙ МЕДИЦИНЫ В 1998г. в России завершена программа клинических испытаний и регистрации (впервые в мире) принципиально нового препарата - нейропротектора ДЕЛЬТАРАН ВФС 42-3066-98. Препарат разработан в Институте биоорганической химии Российской Академии Наук им.М.М.Шемякина и Ю.А.Овчинникова (Москва), при участии Института фармакологии РАМН (Москва), Института Онкологии им.Н.Н.Петрова (С-Петербург), Исследовательского Центра "Комкон" (С-Петербург, научные руководители программы - академик РАН В.Т.Иванов, проф.А.И.Майский). Производитель и поставщик - ИЦ"Комкон". Дельтаран - представитель принципиально нового класса фармакологических препаратов - нейропротекторов с мощным антиоксидантным, стресс протекторным и антидепрессивным действием, обеспечивающих защиту нейронов от разрушения токсическими, инфекционными и другими повреждающими агентами, а также предупреждающих гибель нервных клеток вследствие стресса. СОСТАВ: Дельтаран представляет собой композицию на основе синтетического нонапептида - аналога одного из важнейших природных эндогенных пептидов - открытого в 1977г. регуляторного пептида дельта-сна (ДСИП: дельта-сон индуцирующий пептид) со стабилизирующим клеточный гомеостаз действием. Основной действующий агент препарата производится путем пептидного синтеза в жидкой фазе с последующей очисткой методами высокоэффективной жидкостной хроматографии. ДСИП в свободном и связанном виде присутствует периферических органах, тканях и жидких средах организма, гипофизе, гипоталамусе и лимбической системе мозга. Одной из наиболее впечатляющих черт его широкого мультифункционального действия является ярко выраженная стресспротекторная и адаптогенная активность. Основным механизмом действия препарата является возмещение возникающего при психоэмоциональном или системном стрессе, токсических воздействиях, старении организма дефицита ДСИП, который защищает нейроны от разрушения. Модулирующее, улучшающее скоординированность всех звеньев ЦНС влияние ДСИП реализуется через классические нейромедиаторные системы: адренергические, серотонин - и ГАМК-ергические. Защищая центральную нервную систему от повреждающих воздействий, Дельтаран способен радикально менять течение большого количества заболеваний, так как стрессовые реакции, сопровождающие любой патологический процесс или экстремальное внешнее воздействия, приводят к разрушению нейронов, нарушают работу ЦНС и, следовательно, способность головного мозга поддерживать гомеостаз. Дельтаран не тонизирует нервную систему, но и не является седативным препаратом. Добавляя ДСИП в организм извне, Дельтаран восполняет его дефицит (абсолютный и/или функциональный), обеспечивая восстановление работы центральной нервной системы, оптимизирует ее функционирование и, как следствие - благоприятное течение заболевания, резкое повышение эффективности действия стандартных лечебных препаратов и предупреждение развития осложнений. Дельтаран, являясь по своему биологическому и биохимическому смыслу аналогом ДСИП, филогенетически консервативен, невидоспецифичен, и в силу этого не может нести аллергенной информации. ОСОБЕННОСТИ ФАРМАКОЛОГИЧЕСКИХ СВОЙСТВ: Принципиальная новизна Дельтарана заключается в том, что его антиоксидантное действие препарата в отличие от традиционных антиоксидантов состоит не в поглощении уже образовавшихся свободных радикалов кислорода, но в мощном подавлении самой функции образования свободных радикалов в клетках головного мозга; нейпротекторное действие препарата осуществляется путем предупреждения гипервозбуждения нейронов в процессе нормальных адаптивных реакций, предотвращая их саморазрушение по механизму Exito cyto toxicity. СПОСОБ ПРИМЕНЕНИЯ: Дельтаран представляет собой лиофилизированную субстанцию в герметичной стеклянной ампуле (1 доза содержит 0,3 мг ДСИП), которую вскрывают, добавляют 10-12 капель дистиллированной или охлажденной кипяченой воды, после чего вводят растворенный препарат интраназально: закапывают по 1- 2 капли в среднюю часть носа (зону разветвлений окончаний обонятельного нерва) в каждую ноздрю с интервалом 15-20 минут. Препарат полностью впитывается в слизистую оболочку носа, не попадая в носоглотку. Срок хранения препарата в герметичной ампуле - 2 года (при температуре +4С). ФАРМАКОДИНАМИКА: поглощение: после интраназального введения через 1,5 минуты препарат достигает таламических ядер (стабилизирующий эффект развивается в зависимости от уровня эндогенных пептидов, в течение от 3-х минут до 1,5 часов); распределение: компоненты препарата не специфически транспортируются через гематоэнцефалический барьер и в течение 120 минут распределяются в организме человека приблизительно следующим образом: 80% - печень, 15% - головной мозг, 5% - периферическая кровь (после выхода через гематоэнцефалический барьер компоненты препарата связываются с транспортными белками крови и определяются иммуннохимически в периферической крови в течение 1,5 -2 часов). Дельтаран успешно апробирован в ведущих научных и клинических фармакологических и медицинских учреждениях Москвы (НИИ фармакологии РАМН, Институт биоорганической химии РАН, НИИ скорой помощи), Санкт-Петербурга (Российская военно-медицинская Академия, НИИ Онкологии, Медицинская Академия последипломного образования, Институт мозга человека РАН, Центр передовых медицинских технологий, Детский ожоговый центр), Нижнего Новгорода (Областной кардиологический центр, Областной геронтологический центр), Екатеринбурга (Уральский окружной военно-клинический госпиталь, Областная клиническая больница, Уральский медицинский государственный Университет), Ростова (Региональное отделение Секции прикладных проблем АН, Государственный Университет) и других городов. Обладая, в силу механизма своего действия ярко выраженным антристрессовым действием, Дельтаран показал в ходе клинических испытаний и апробации опытных серийных партий препарата свою высокую эффективность, как при профилактике постстрессовых расстройств для представителей профессий, нормальной составляющей которых является постоянная работа в условиях физического, интеллектуального и психоэмоционального стресса, так и при лечении последствий профессиональных травматических поражений работников таких экстремальных профессий (ранения, производственные травмы, токсические и радиационные поражения, ожоговые травмы и обморожения). К таким группам риска должны быть отнесены военнослужащие (прежде всего - из состава ВВС, ВМФ, особенно подводников, РВСН, спецподразделений, оперативного состав МВД и ВВ, МЧС), летный состав и авиадиспетчеры гражданской авиации, работники ядерной и химической промышленности, "горячих" металлургических цехов, эксплуатационный персонал атомных электростанций и др. Дельтаран оказывается эффективным при профилактике воздействий трех основных групп неблагоприятных факторов, существенно влияющих, как на качество выполняемой деятельности, так и на длительность жизни работников экстремальных профессий: 1) географических факторов (перемещения в меридианном и широтном направлениях, что требует адаптации)? 2) факторов внешней среды обитаемости (климат, газовый состав воздуха, барометрическое давление, шум, вибрация, ионизирующие излучения и т. д.), возможность и полнота адаптации к которым зависят, как от параметров фактора, так и от продолжительности его непрерывного действия? 3) особенностей профессиональной деятельности (изменение режима труда и отдыха, гипокинезия, невесомость, перегрузки, сенсорная депривация, монотония, высокое психоэмоциональное напряжение и др.). Особую группу риска составляют ликвидаторы последствий Чернобыльской аварии (ЛПА) - к этой группе относятся и ликвидаторы других чрезвычайных техногенных ситуаций в атомной промышленности. Результаты многолетних исследований ведущих научно-медицинских учреждений РФ свидетельствуют, что в настоящее время, спустя более 10 лет, более чем у половины ЛПА обнаруживаются и прогрессируют астенические, неврозоподобные, депрессивные, интеллектуально- мнестические расстройства, как правило, в сочетании с вегетативно-сосудистыми нарушениями. Структура нарушений и данные обследования показывают, что патогенез нейрофизиологических расстройств определяется церебральными сосудистыми сдвигами и сопряжёнными с ними изменениями вегетативной, обменно-эндокринной регуляции. Выявлены признаки раннего старения, видимо, связанные с нейродегенеративными процессами. Нейрофизиологические изменения состоят в дисфункции диэнцефальных структур, базальных ганглиев (32%) и ирритативно-дистрофических изменениях в коре головного мозга (66%). Прогрессирует цереброваскулярная недостаточность, снижается энергообеспеченность тканей мозга, развивается хроническая гипоксия мозговых структур. Выявляется неполноценность антиоксидантных систем организма. Традиционное применение в этих случаях психостимуляторов, гормональных препаратов далеко небезопасно для здоровья использующего их человека и связано с высоким риском тяжёлых побочных эффектов этих препаратов. В войсках и службах МЧС Дельтаран рекомендован к применению, как для личного состава, так и для массового приема пострадавшими в зоне катастроф или стихийных бедствий для снятия постстрессовых шоковых реакций, повышения адекватности поведения пострадавших и снижения риска массовых заболеваний в полевых условий или лагерях беженцев. По механизму своего действия Дельтаран является высокоэффективным радиопротектором, что подтверждено экспериментальными результатами. Таким образом, применение DSIP-содержащего препарата Дельтаран показано у лиц, профессиональная деятельность которых протекает в условиях физического и психоэмоционального напряжения и перенапряжения, а также для коррекции расстройств, вызванных данными видами деятельности. При текущих процессах нейродегенерации возможна как стабилизация, так и обратное развитие процесса. Рекомендуемые дозы препарата должны зависеть от ситуации и от исходного состояния пациента. Применение Дельтарана для лечения последствий профессиональных травм и поражений в ходе экстремальной профессиональной деятельности показано для усиления эффекта стандартных схем лечения, уменьшения курсовых доз назначенных препаратов и побочных эффектов от них (в том числе интоксикаций при интенсивной химио- и радиотерапии), ускорения реабилитации. Дельтаран эффективен при любых поражениях нервной системы, независимо от их природы (травматических, токсических, радиационных и др.), включая: ишемию мозга, черепно-мозговые травмы и сотрясения мозга, поражения периферической нервной системы (в т.ч. радикулит) и т.д. При огнестрельных ранах и переломах применение Дельтарана ускоряет заживление. Производилась оценка действия Дельтарана во время проведения боевых действий в Чечне. В экстремальных ситуациях применение препарата резко уменьшило количество осложнений нейропсихического характера. При применении препарата у раненых ускорялись процессы заживления и реабилитации, уменьшалось количество осложнений (данные не опубликованы). При обширных и глубоких ожогах Дельтаран позволяет резко ускорить выведение из шокового состояния и увеличить эффект приживления трансплантантов (положительные результаты получены в Санкт-Петербургском детском ожоговом центре при лечении больных с ожогами до 60% и неблагоприятных начальных прогнозах). Побочные действия препарата не обнаружены, противопоказаний к применению не установлено, Следует отметить, что яркость проявления эффектов применения Дельтарана тем выше, чем тяжелее ситуация, поэтому объективизация оценки эффектов применения Дельтарана делает желательным проведение адекватного клинико-диагностического контроля. Дозировка препарата определяется тяжестью ситуации (до 5 ампул в день). Передозировка препарата исключена, так как его излишки используются организмом в качестве питания. Адекватных зарубежных аналогов в настоящее время не существует. Разработанный препарат Ciba-Gelgy Аcea 1024 обладает более узким спектром действия, не является прямым дериватом ДСИП и содержит чужеродные для организма человека субстанции, в силу чего имеет ряд побочных, в том числе аллергенных действий. Проходящий предрегистрационные испытания препарат Hoffman La Roshe (AG Clinalfa) DSIP Clinalfa имеет более узкую сферу применения (наркология и расстройства сна), его способ употребления (внутривенный) менее удобен и эффективен, кроме того, он в несколько раз дороже Дельтарана. Сердечные гликозиды
Схема механизмов действия инотропных препаратов.
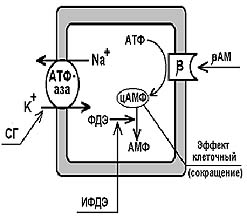
Механизм действия кардиотоников.
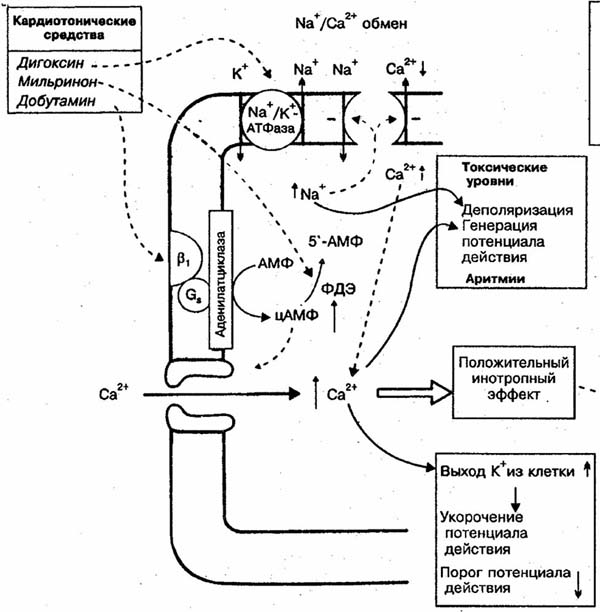
ФАРМАКОДИНАМИКА КАРДИАЛЬНЫЕ ЭФФЕКТЫ
Положительный инотропный
Отрицательный хронотропный
Отрицательный дромотропный
Положительный батмотропный
Дигитализация на ЭКГ: удлинение PQ в пределах нормы и снижение ST на 1 мм ниже изолинии.
ФАРМАКОДИНАМИКА ВНЕКАРДИАЛЬНЫЕ ЭФФЕКТЫ
Диуретический эффект
Вазоконстрикция сосудов малого круга и сосудов брызжейки
Вазодилятация скелетной мускулатуры
Опосредованное действие (рефлекторное) на блуждающий нерв.
СЕРДЕЧНЫЕ ГЛИКОЗИДЫ. ФАРМАКОДИНАМИКА
Положительное инотропное действие равно проявляется при наличии или отсутствии патологии миокарда.
У здоровых людей СВ не меняется или не достоверно снижается, а ОПСС увеличивается за счет прямой констрикции сосудов.
У больных СН увеличение силы сокращения приводит к увеличению СВ и снижению КДД и КДО ЛЖ и ОПСС.
Увеличение сократимости миокарда и СВ рефлекторно уменьшает симпатический тонус и вызывает уменьшение ЧСС и увеличение диуреза у больных с отеками.
СГ не оказывают прямого действия на почки.
У больных без СН увеличение сократимости миокарда может сопровождаться повышением его потребности в кислороде.
СГ не уменьшают коронарный кровоток и у больных СН, восстановление эффективной работы сердца может улучшать коронарную циркуляцию.
СГ оказывают незначительное инотропное действие на скелетную мускулатуру.
Снижение ЧСС у больных без СН является отрицательным эффектом, так как это следствие холинергических и симпатолитических влияний на СА узел.
При токсических дозах этот эффект обусловлен прямым снижением автоматизма синусового узла.
В терапевтических дозах СГ оказывают минимальное воздействие на желудочки без холинергических и симпатолитических влияний.
Высокие концентрации СГ вызывают повышение автоматизма и активности эктопических очагов - положительное батмотропное действие.
СГ снижают скорость проведения импульса через AV узел и удлиняют ЭПР AV узла за счет повышения активности блуждающего нерва и симпатолитического эффекта.
В обычных дозах СГ не оказывают прямого влияния на скорость проведения и рефрактерность в системе Гиса-Пуркинье.
СГ укорачивают ЭПР предсердий и увеличивают скорость проведения за счет рефлекторного повышения тонуса блуждающего нерва и прямого действия на предсердия.
СГ могут вызывать удлинение интервала PR, укорочение интервала QT, сегментарную депрессию интервала ST.
Все СГ имеют общий механизм действия и фармакодинамику.
Исходно метаболический потенциал миокарда должен быть на уровне вероятного «ответа» на стимуляцию СГ. Рецепторы СГ распределяются пропорционально массе “сохраненного” миокарда.
Выраженность ФД эффектов СГ зависит от функциональных параметров миокарда в момент назначения и, вполне возможно, что на первый план выступит не инотропное действие, которое может вообще не проявиться, а влияние на проводящую систему или эктопические очаги желудочков.
ФАРМАКОКИНЕТИКА
|
Строфантин |
Дигоксин |
Дигитоксин |
Связь с белком, % |
До 40 |
40-60 |
98 |
Продолжитель-ность действия |
3-5 сут
|
7-14 сут
|
21 сут
|
Метаболизм |
- |
печень, 40-60% |
Печень, энтеропе-ченочная циркуляция |
Элиминация |
Почки, в не-измененном виде 99,9% |
Почки в виде метаболитов и неизмененного препарата |
Почки, фекалии в виде метаболитов |
Насыщающая доза |
0,6 мг |
2,0 мг |
2,0 мг |
Поддерживающая доза, мг |
0,24 |
0,4 |
0,15
|
Квота элиминации |
40% |
20% |
7% |
Режим дозирования |
в/в 2 раза в сутки |
в/в и внутрь 2-3 раза в сутки |
внутрь
|
ПОКАЗАНИЯ К НАЗНАЧЕНИЮ
Мерцательная аритмия
Сердечная недостаточность
ИССЛЕДОВАНИЕ DIG (Digitalis Investigation Group, 1997)
ПОКАЗАНИЯ К НАЗНАЧЕНИЮ ДИГОКСИНА:
Все больные ХСН и МЕРЦАНИЕМ ПРЕДСЕРДИЙ, у которых необходим контроль за ритмом сокращений желудочков.
Больные тяжелой ХСН III и IV ФК если:
Симптомы ХСН сохраняются, несмотря на терапию диуретиками и ингибиторами АПФ.
Больные более 1 раза госпитализировались в связи с декомпенсацией ХСН.
Фракция выброса менее 25% или выраженная кардиомегалия (!?).
РОЛЬ ДИГОКСИНА В ЛЕЧЕНИИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Дигоксин рекомендуется использовать для улучшения клинического статуса больных ХСН, вызванной систолической дисфункцией ЛЖ в сочетании с диуретиками, ИАПФ и ББ.
Дигоксин рекомендуется назначать больным ХСН и тахисистолической формой мерцания предсердий, хотя возможно, что у таких больных ББ будут лучше контролировать ЧСС во время физической нагрузки.
АБСОЛЮТНЫЕ ПРОТИВОПОКАЗАНИЯ К НАЗНАЧЕНИЮ
Синдром Вольфа-Паркинсон-Уайта
Желудочковые нарушения ритма
Идиопатический субаортальный стеноз аорты
AV блокады II-III степени
СОСТОЯНИЯ ПРИ КОТОРЫХ НЕЦЕЛЕСООБРАЗНО ПРИМЕНЕНИЕ СЕРДЕЧНЫХ ГЛИКОЗИДОВ
Нарушение диастолического наполнения ЛЖ:
митральный стеноз
рестриктивные поражения миокарда
гипертрофия левого желудочка без выраженной дилятации (при АГ).
Сердечная недостаточность с высоким СВ:
тиреотоксикоз
анемия
бери-бери
Легочное сердце.
СОСТОЯНИЯ, ПРЕДРАСПОЛАГАЮЩИЕ К РАЗВИТИЮ ДИГИТАЛИСНОЙ ИНТОКСИКАЦИИ
Молодой и пожилой возраст
Ишемия миокарда
Патология почек
Гипоксия, ацидоз
Гипокалиемия, гипокалигистия
Гипотиреоз
Патология печени
Гиперкальциемия
Миокардиты
Гипомагниемия
РЕЖИМ ДОЗИРОВАНИЯ СЕРДЕЧНЫХ ГЛИКОЗИДОВ
СГ имеют низкий терапевтический индекс, в связи с этим доза препаратов подбирается индивидуально.
Для подбора дозы имеют значение такие параметры как индивидуальная чувствительность и ответ, общее состояние больного, сердечно-сосудистый статус, функция печени и почек и плазменная концентрация сердечных гликозидов.
Доза СГ базируется на идеальной массе тела.
Дигоксин: 10-15 мкг/кг
Дигитоксин: 30 мкг/кг или 750 мкг/м 2
РЕЖИМ ДОЗИРОВАНИЯ ДИГОКСИНА ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Согласно рекомендациям Европейского общества кардиологов (1997), обычная доза ДИГОКСИНА:
При нормальном уровне креатинина 0,25-0,375 мг/сут.
У пожилых больных 0,0625-0,125 мг/сут, редко 0,25 мг/сут.
При почечной недостаточности доза Дигоксина снижается соответственно клиренсу креатинина.
КОНТРОЛЬ ЭФФЕКТИВНОСТИ
Контроль за динамикой ЧСС.
Контроль ЭКГ для своевременного выявления первых признаков гликозидной интоксикации.
Клиническая оценка гемодинамического действия СГ (увеличение диуреза, улучшение субъективного состояния, сокращение размеров “застойной” печени, уменьшение отеков) и их возможного токсического влияния.
Инструментальное определение инотропного действия гликозидов: ЭхоКС.
Определение концентрации препарата в крови
ДИГИТАЛИСНАЯ ИНТОКСИКАЦИЯ
Желудочно-кишечный тракт: анорексия, тошнота, рвота, боли в животе.
Аритмические: чаще аллоритмия (би- и тригимения), возможны все виды аритмий.
Орган зрения: ксантопсия, скатомы.
Эндокринная система: гинекомастия, импотенция.
Психическая сфера: острые психозы, депрессия и др.
Аллергические реакции.
ЛЕЧЕНИЕ ДИГИТАЛИСНОЙ ИНТОКСИКАЦИИ
СПЕЦИФИЧЕСКОЕ:
Fab-фрагмент антител к дигоксину или Дигибайнд.
ЛЕЧЕНИЕ АРИТМИЙ:
Лидокаин
Пропранолол
Дифенин
Изадрин, Платифиллин
ГКС
Водитель ритма
ЛЕКАРСТВЕННЫК СРЕДСТВА, ВЛИЯЮЩИЕ НА ФАРМАКОДИНАМИКУ:
Унитиол
ЭДТА
Дифенин
Соли калия
ЛЕКАРСТВЕННЫК СРЕДСТВА, ВЛИЯЮЩИЕ НА ФАРМАКОКИНЕТИКУ:
Активированный уголь
Холестирамин
Вазелиновое масло
ВЗАИМОДЕЙСТВИЕ СЕРДЕЧНЫХ ГЛИКОЗИДОВ:
УЛУЧШАЮЩИЕ ПЕРЕНОСИМОСТЬ
Кокарбоксилаза
Фолиевая кислота
Витамин Е.
ФИЗИКО-ХИМИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ
Гипертонический раствор глюкозы,
Раствор гидрокарбоната натрия
Эуфиллин
Аскорбиновая кислота
Современные лекарственные средства в лечении артериальной гипертензии новые или хорошо известные? Л.ОЛЬБИНСКАЯ, академик РАМН, ММА им. И.М.Сеченова
Артериальная гипертензия (АГ) — патологическое состояние, при котором повышение АД обусловлено не естественными потребностями организма в тех или иных физиологических ситуациях, а разбалансировкой системы регуляции АД в целом. Целевые уровни АД: в общей популяции больных АГ < 140/90 мм рт.ст., в группе больных АГ и сахарным диабетом с протеинурией < 1г/сут — < 130/85 мм рт.ст., в группе больных АГ и сахарным диабетом с протеинурией > 1г/сут — < 120/75 мм рт.ст., в группе больных АГ и хронической печеночной недостаточностью (ХПН) < 120/75 мм рт.ст. Чем выше абсолютный риск, тем большее значение имеет достижение целевого уровня АД.
Какими средствами мы можем снизить АД? Существуют 4 основные группы специфических антигипертензивных препаратов. 1-я группа — антиадренергические средства. К ним относятся ганглиоблокаторы (бензогексоний), постганглионарные адреноблокаторы (резерпин, гуанитидин), α-адреноблокаторы (фентоламин, тропафен, пироксан, празозин, доксазозин), α- и β-адреноблокаторы (лабеталол, албетол, проксодолол), центральные симпатолитики (клонидин, метилдофа, эстулик). 2-я группа — вазодилататоры — представлена двумя подгруппами: артериальные (апрессин, гидралазин, диазоксид, коринфар) и смешанные (нитропруссид натрия, празозин, каптоприл, рамиприл и другие ингибиторы АПФ). 3-я группа — диуретики: тиазидные диуретики (гипотиазид), диуретики петли Генле (фуросемид, лазикс), калийсберегающие диуретики (триамтерен, амилорид, азоламин). 4-я группа — агонисты имидазолиновых рецепторов (физиотенз, альбарел).
Каковы стратегия и тактика применения антигипертензивных лекарственных средств для лечения АГ? Существует ступенчатая методика терапии. Она включает в себя 5 ступеней. 1-я ступень: ограничение употребления натрия и алкоголя, контроль массы тела. 2-я ступень: диуретики, или β-блокаторы, или антагонисты кальция, или ингибиторы АПФ. 3-я ступень: добавить второй препарат другого класса, повысить дозу первого препарата или заменить другим препаратом. 4-я ступень: добавить третий препарат другого класса или заменить второй препарат. 5-я ступень: дальнейшее обследование или добавление третьего или четвертого препарата. В настоящее время ступенчатая методика заменена термином «алгоритм выбора лекарственных средств». Фактически он повторяет ступенчатую методику, но более конкретен (рис.1).
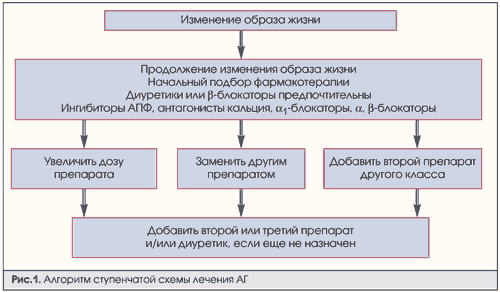
Рассмотрим различные группы лекарственных средств. В настоящее время препаратами первого выбора являются диуретики и β-адреноблокаторы.
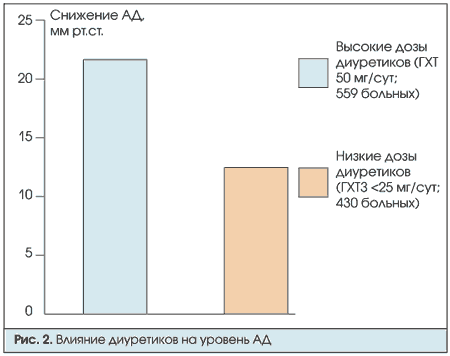
Диуретики. При применении широко распространенных диуретических препаратов гидрохлортиазида (ГХТ) необходимо помнить о их дозозависимом эффекте (рис.2). У больных АГ, как правило, применяют ГХТ в дозе 25—50 мг.
|
|
В последние годы появились диуретики с другим механизмом действия — не салуретики: индапамид и ксипамид. Индапамид (арифон — 2,5 мг; арифон-ретард — 1,5 мг) — сульфонамидный диуретический препарат, имеющий в структуре индольное кольцо. Антигипертензивное действие его обусловлено: почечным салуретическим эффектом; вазодилатирующим эффектом за счет прямого влияния на сосудистую стенку, где происходит регуляция входа кальция в гладкомышечные клетки и за счет усиления синтеза ПГЕ2 (секретируемого почками) и простациклина (секретируемого клетками эндотелия сосудов).
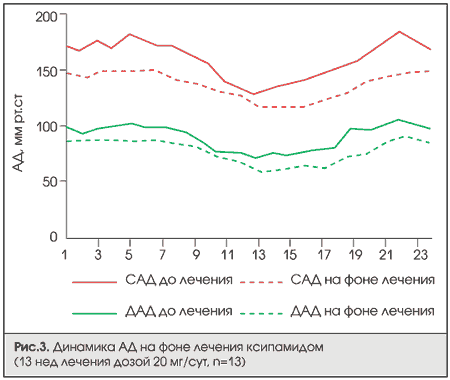
Ксипамид (аквафор) — оказывает диуретическое действие благодаря усилению кровоснабжения почек за счет вазодилатирующего эффекта. Влияет как на систолическое, так и на диастолическое АД (рис. 3), эффективен при однократном приеме в течение суток.
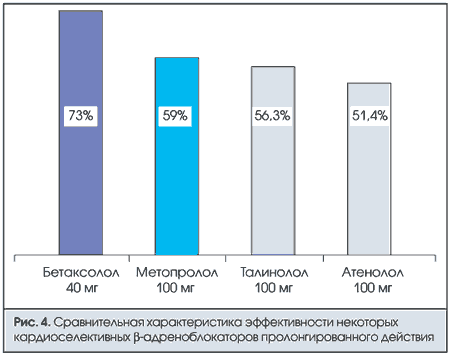
β-адреноблокаторы — вторая широко распространенная группа препаратов. В каких случаях при гипертонической болезни показаны β-адреноблокаторы? Это пациенты с гиперкатехоламинемией, гиперсимпатикотонией, тахикардией, большим минутным объемом сердца, большим сердечным выбросом, нормальным или пониженным тонусом резистивных сосудов, нормальным или корригированным липидным спектром. Если посмотреть на эффективность наиболее часто используемых β-адреноблокаторов (рис. 4), то наиболее эффективными являются препараты бетаксолола. Наименее эффективен атенолол, хотя он используется в России чаще других, что требует изменения взгляда врачей на выбор препарата.
|
|
При выборе β-адреноблокаторов надо учитывать следующее: гидрофильный или липофильный препарат, состояние почек и печени, продолжительность действия, фармакокинетические и фармакодинамические, агонистические и мембраностабилизирующие свойства, селективность.
Выбор β-адреноблокаторов гидрофильной или липофильной группы зависит от скорости клубочковой фильтрации. Так, при скорости клубочковой фильтрации 80—120 мл/мин возможно назначение гидро- и липофильных β-адреноблокаторов в любой терапевтической дозе (атенолол 100 мг 2 раза в сутки). При скорости клубочковой фильтрации 15—35 мл/мин доза гидрофильных β-адреноблокаторов уменьшается до 1/2—1/3 от среднетерапевтической (атенолол 50 мг/ сут). При снижении скорости клубочковой фильтрации до 15 мл/мин доза гидрофильных β-адреноблокаторов снижается до минимальной или их назначают через день (атенолол 50 мг через день) или используют липофильные β-адреноблокаторы. При печеночной недостаточности преимущество имеют гидрофильные β-адреноблокаторы, доза липофильных — в 1,5—2 раза меньше среднетерапевтической.
Пролонгированные кардиоселективные β-адреноблокаторы хорошо совместимы с другими лекарственными средствами: с дигидропиридиновыми антагонистами кальция, оральными гипогликемическими средствами, α-адреноблокаторами, сердечными гликозидами, ингибиторами АПФ, блокаторами Н2-гистаминовых рецепторов, антикоагулянтами, симпатолитиками, диуретиками, оральными гиполипидемическими средствами.
Следует выделить новое поколение β-адреноблокаторов: небиволол (небилет). Он обеспечивает высокоселективную β-адреноблокаду в сочетании с модулированием эндотелиальной дисфункции. Назначается по 5—10 мг раз в сутки. Небиволол — это рацемическая смесь двух изомеров: D-изомера и L-изомера. D-изомер — b1-адреноблокатор, урежает ЧСС, снижает ударный объем, повышает общее периферическое сопротивление сосудов (ОПСС). L-изомер — модулятор NO-синтеза, эндотелийзависимой венодилатации и артериолодилатации, снижает ОПСС, улучшает диастолическую функцию сердца, повышает фракцию выброса (L.Stoleru,1993). Небилет — оптимальный препарат для лечения больных АГ в стационаре и поликлинике: он плавно в течение суток снижает АД, нормализует ЧСС без ночного урежения, расширяет артериальные сосуды и снижает ОПСС, улучшает мозговой и тканевой кровоток, не ухудшает липидный профиль, оказывает дозозависимое действие, может быть препаратом выбора у больных АГ в сочетании с ИБС, нарушениями углеводного и липидного обмена.
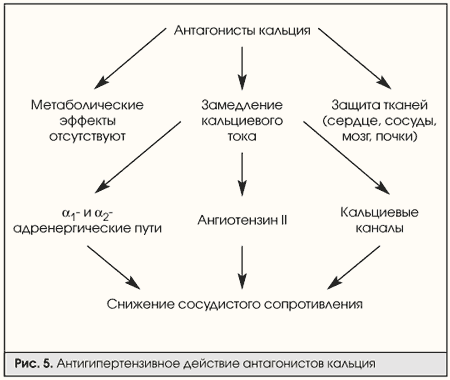
Антагонисты кальция. Основной механизм их действия — снижение сосудистого тонуса за счет влияния на a1- и a2-адренергические пути, ангиотензин II, кальциевые каналы. Схема действия препаратов этой группы показана на рис. 5.