
ЛАБОРАТОРНАЯ РАБОТА 1-6
.docЛАБОРАТОРНАЯ РАБОТА 1-6
ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКОГО ЦИКЛА ХОЛОДИЛЬНОЙ
МАШИНЫ НА УСТАНОВКЕ КЛЕМАНА-ДЕЗОРМА
1. ЦЕЛЬ РАБОТЫ: изучение адиабатно-изохорно-изотермического цикла воздушной холодильной машины на установке Клемана-Дезорма.
2. ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: стеклянный сосуд с краном, ручной насос, манометр.
3. МЕТОД ИЗМЕРЕНИЙ: измерение давления газа в изохорическом и адиабатическом процессах позволяет вычислить работу, совершаемую газом, коэффициент Пуассона и КПД установки.
4. ВВЕДЕНИЕ.
Любой круговой термодинамический процесс, совершаемый газом, в зависимости от его направления можно рассматривать как цикл тепловой или холодильной машины.
В опыте Клемана-Дезорма воздух совершает круговой процесс (рис. 1), который состоит из изотермы 31, адиабаты 12 и изохоры 23.
Этот цикл, в частности, применяется в охладителях электронных блоков.
Для SVT – цикла холодильный коэффициент равен отношению количества тепла, отнятой газом у охлажденного тела Q23, к работе цикла
Aц = A31 – A12.
=![]() (1.6.1.)
(1.6.1.)
где A31 – работа изотермического сжатия воздуха;
A12 – работа адиабатического расширения газа.
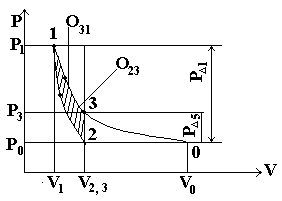
Рис.1
Из первого закона термодинамики
-Q31 + Q23 = -A31 + A12 (1.6.2.)
ввиду равенства Q31 = A31, следует, что Q23 = A12.
Тогда (1.6.1.) можно представить иначе:
=
 (1.6.3.)
(1.6.3.)
Работу изотермического сжатия газа можно выразить с учетом закона Бойля-Мариотта в виде равенства:
![]() (1.6.4.)
(1.6.4.)
где P0 – атмосферное движение воздуха;
V0 – объем колбы.
Работу адиабатического расширения воздуха можно выразить в виде следующего соотношения
![]() (1.6.5.)
(1.6.5.)
где - коэффициент Пуассона
![]() (1.6.6.)
(1.6.6.)
где Cp, Cv – теплоемкости воздуха соответственно при постоянном давлении и постоянном объеме.
Из закона
Бойля-Мариотта следует, что
![]() .
Но V2 = V3.
Тогда
.
Но V2 = V3.
Тогда
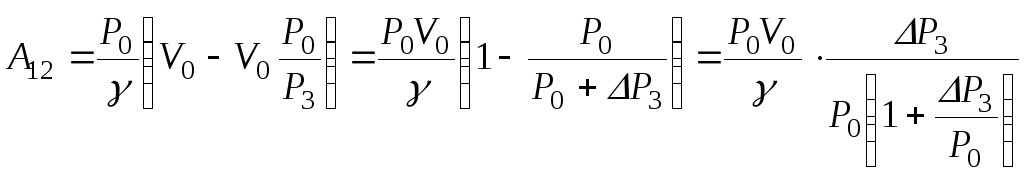 (1.6.7.)
(1.6.7.)
Для вычисления необходимо знать коэффициент . Он может быть найден как отношение угловых коэффициентов адиабаты и изотермы. Из уравнений S и T- процессов следует
PV
= const; P =
![]()
![]() (1.6.8.)
(1.6.8.)
PV = const;
P =
![]()
![]() (1.6.9.)
(1.6.9.)
Учтя (1.6.9.), уравнение (1.6.8.) запишем в виде
![]() (1.6.10)
(1.6.10)
Это равенство выполняется при любом значении V, значит, оно выполняется и для средних значений, которые на интервале V=V3-V1 равны соответственно
![]() ;
;
![]()
Тогда
![]()
Откуда
=
![]() (1.6.11.)
(1.6.11.)
или
![]() (1.6.12)
(1.6.12)
где h1 и h3 – разности уровней воды в U – образном манометре соответственно в точке 1 процесса 31 и точке 3 процесса 23 (см. рис. 1). Ввиду наибольших значений h1 и h3, а также V1 и V2 можно аппроксимировать кривые адиабаты и изотермы кремния линиями.
Тогда
![]() (1.6.13.)
(1.6.13.)
![]() (1.6.14.)
(1.6.14.)
где V = V2 – V1, поставив (1.6.13.) и (1.6.14.) в (1.6.3.), найдем
![]() (1.6.15.)
(1.6.15.)
Учтя (1.6.12.), получим
![]() (1.6.16.)
(1.6.16.)
4. ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА.
Цикл проводится на установке Клемана-Дезорма рис. 2.
Баллон 1 объемом V0 = 20 дм3 через кран 3 может сообщаться либо с насосом 4, либо с атмосферой. Избыточное давление воздуха в баллоне определяется с помощью U – образного водяного манометра 2.
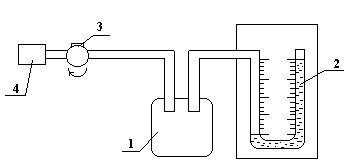
Рис.2
5. ПРОВЕДЕНИЕ ЭКСПЕРИМЕНТА.
5.1. В первоначально открытый баллон насосом накачивают воздух. Сделав 3-5 качаний насосом и выждав 5-7 минут, пока воздух не охладится до комнатной температуры (при этом перестает уменьшаться давление в баллоне), записать установившееся избыточное давление P1, которое пропорционально разности уровней в коленах манометра h1. В результате воздух сжат накачанным воздухом до давления P1 = P0 + P1, где P0 – атмосферное давление (состояние 1 на рис. 1).
5.2. Открыть кран в атмосферу. Как только избыточное давление в баллоне упадет до нуля, закрыть кран. Процесс проводить достаточно быстро, чтобы считать его адиабатным (переход в состояние 2). Когда воздух в баллоне, охладившийся при адиабатном расширении, нагреется до комнатной температуры (при этом перестанет увеличиваться давление в баллоне), записать значение установившегося избыточного давления P3 (или h3 ). Действия п. 5.1. и 5.2. выполнить 10 раз.
5.3. По барометру и термометру, имеющимся в лаборатории, измерить атмосферное давление P0 и температуру воздуха T0.
6. ОБРАБОТКА РЕЗУЛЬТАТОВ.
6.1. Вычислить по
формуле (1.6.12.) значение 1.
Найти среднее значение
![]() и погрешность
и погрешность
![]() с доверительной вероятностью P
= 95 %.
с доверительной вероятностью P
= 95 %.

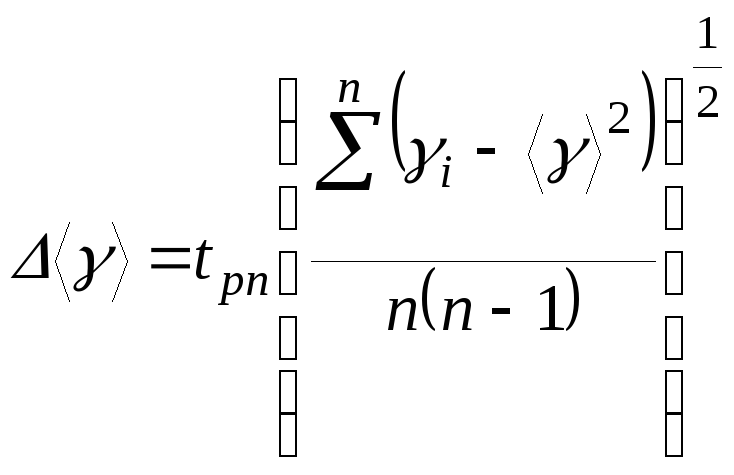 (1.6.17.)
(1.6.17.)
где tpn – коэффициент Стьюдента. Его следует принять равным 2,262 при n = 10 и P = 95 %.
6.2. Вычислить по формуле (1.6.16.) холодильный коэффициент. Результаты опытов, их обработка должна быть сведены в таблицу 1.
Таблица 1
|
№ п/п |
h1i |
h3i |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
... |
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
-
Сделать вывод: соответствует ли вычисленное значение коэффициента Пуассона его истинному значению для воздуха.
7. КОНТРОЛЬНЫЕ ВОПРОСЫ.
7.1. Сформулируйте принцип Карно для идеальной тепловой машины.
7.2. Изобразите цикл 1231 (см. рис. 1) в T-S – диаграмме.
7.3. Определите число степеней свободы для молекул газов, из которых состоит воздух.
7.4. Вычислите изменение внутренней энергии воздуха в процессах 12 и изменение энтропии в процессах 23 и 31 (см. рис. 1).
8. ЛИТЕРАТУРА.
8.1. Савельев И.В. Курс общей физики. Т.1. Механика. Молекулярная физика. М.: Наука. 1982. – 432 с. §§ 87, 88, 89, 105.
8.2. Сивухин Д.В. Общий курс физики. Т. 22. Термодинамика и молекулярная физика. М.: Наука. 1990. – 592 с. §§ 22, 30.

