
- •18. Равновесие фаз
- •Условие равновесия фаз
- •Уравнение Клапейрона — Клаузиуса
- •Правило фаз Гиббса
- •Материальный баланс и уравнение рабочей линии абсорбции
- •20. Насадочные абсорберы
- •21. Простая перегонка
- •[править]Связь с другими законами состояния идеального газа
- •Равновесие между жидкостью и паром
- •29.30. Сушка
- •4.6.2. Конструкции сушилок и области их применения
- •4.6.3. Материальный и тепловой балансы сушки
vk.com/club152685050 | vk.com/id446425943
теплоты, плохую смачиваемость насадки при низких плотностях орошения, большие объемы насадки вследствие недостаточно высокой ее эффективности (по сравнению с тарельчатыми аппаратами).
21. Простая перегонка
Простая перегонка применяется только в тех случаях, когда требуется отделение целевого продукта от практически нелетучих примесей.
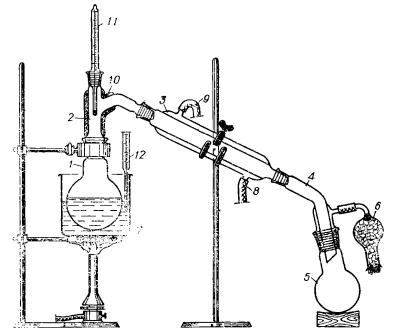
Рис. 67. Установка для простой перегонки: 1 — перегонная колба; 2 —насадка Вюрца: 3— водяной холодильник; 4— алонж; 5—приемный сосуд; 6 — хлорхальцпевая трубка; 7 — жидкостная баня; S — патрубок для входа воды; 9 —патрубок для слива воды; 10— асбестовая изоляция; 11, 12 — термометры.
Это условие выполняется, например, при очистке жидкостей от растворенных смолистых, окрашенных и прочих высокомолекулярных веществ, от нелетучих солей (получение дистиллированной воды), от механических примесей, если фильтрование по каким-либо причинам не может быть применено.
Традиционная установка для простой перегонки при атмосферном давлении изображена на рис. 67. Установка состоит из перегонной колбы, насадки Вюрца, снабженной термометром (вместо колбы с насадкой можно использовать колбу с отводной трубкой— колбу Вюрца), водяного холодильника, алонжа и приемной колбы.
При сборке установки следует руководствоваться следующими правилами.
1.Перегонную колбу выбирают с таким расчетом, чтобы перегоняемая жидкость занимала не менее 1/2 и не более 2/3 ее объема.
2.Температура паров перегоняемого вещества измеряется перед отводной трубкой, но не над самой поверхностью жидкости. Шарик термометра должен полностью омываться парами, для чего его располагают на 0,5—1 см ниже отверстия отводной трубки.

vk.com/club152685050 | vk.com/id446425943
3.Холодильники с водяным охлаждением применяют для перегонки жидкостей, кипящих при температуре не выше 140—150 °С. Более высококипящпе вещества перегоняются с использованием воздушных холодильников (см. рис. 45).
4.При необходимости предохранять перегоняемый продукт от влаги воздуха к отводу алонжа присоединяют хлоркальциевую трубку. Если приемник присоединяется к алонжу с помощью шлифа или пробки, затыкать отвод алонжа нельзя — прибор обязательно должен иметь сообщение с атмосферой.
5.Установку закрепляют на штативах таким образом, чтобы при необходимости прекратить перегонку можно было опустить обогревающую баню, не поднимая всей установки.
Следует также позаботиться о том, чтобы во время перегонки можно было быстро заменить приемник, не разбирая установки. Для этого приемник должен стоять на специальной подставке или на подъемном столике (рис. 68), а не на поверхности рабочего стола.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула,
устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 ,
,
где
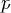 — давление,
— давление,
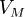 — молярный объём,
— молярный объём,
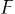 — универсальная газовая постоянная
— универсальная газовая постоянная
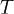 — абсолютная температура,К.
— абсолютная температура,К.
Так как 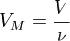 , где
, где 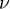 — количество вещества, а
— количество вещества, а 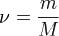 , где
, где 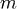 — масса,
— масса, 
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна 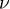 , коэффициент пропорциональности
, коэффициент пропорциональности  он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
[править]Связь с другими законами состояния идеального газа
В случае постоянной массы газа уравнение можно записать в виде:

vk.com/club152685050 | vk.com/id446425943
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
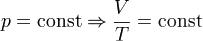 — Закон Гей-Люссака.
— Закон Гей-Люссака.
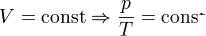 — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции 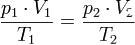 этот закон удобен для расчёта перевода газа из одного состояния в другое.
этот закон удобен для расчёта перевода газа из одного состояния в другое.
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
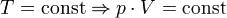 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627— 1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где 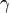 — показатель адиабаты,
— показатель адиабаты,  — внутренняя энергия единицы массы вещества.
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это
