
- •18. Равновесие фаз
- •Условие равновесия фаз
- •Уравнение Клапейрона — Клаузиуса
- •Правило фаз Гиббса
- •Материальный баланс и уравнение рабочей линии абсорбции
- •20. Насадочные абсорберы
- •21. Простая перегонка
- •[править]Связь с другими законами состояния идеального газа
- •Равновесие между жидкостью и паром
- •29.30. Сушка
- •4.6.2. Конструкции сушилок и области их применения
- •4.6.3. Материальный и тепловой балансы сушки

vk.com/club152685050 | vk.com/id446425943
17. Абсорбция – это физико-химический процесс поглощения веществ из раствора или смеси газов твердыми телами или жидкостями с образованием растворов.
При Абсорбции поглощение веществ происходит во всем объеме поглотителя. Абсорбция широко применяется в технике, главным образом при разделе газообразных смесей на составные части путем растворения одного или нескольких компонентов этой смеси в жидкости, которая называется абсорбентом.
Физическая сущность процесса Абсорбции объясняется так называемой пленочной теорией. Согласно этой теории, при соприкосновении жидкости и газообразных веществ, на поверхности раздела обеих фаз образуются жидкостная и газовая пленки. Растворимый в жидкости компонент газообразной смеси проникает путем диффузии сначала сквозь газовую пленку, а затем и сквозь жидкостную и поступает во внутренние слои абсорбента.
Для осуществления диффузии необходимо, чтобы концентрация растворенного компонента в газообразной смеси превосходила его равновесную концентрацию над жидкостью.
Если концентрация растворимого компонента в газообразной смеси меньше его равновесной концентрации над жидкостью, диффузия происходит в обратном направлении. В этом случае вместо поглощения растворенного компонента наблюдается его выделение из раствора в газообразном состоянии. Такой процесс называется десорбцией и применяется в технике для извлечения поглощенных веществ из абсорбента.
18. Равновесие фаз
Материал из Википедии — свободной энциклопедии
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового,механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Условие равновесия фаз
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.

vk.com/club152685050 | vk.com/id446425943
Потенциал Гиббса такой системы будет равен
 ,
,
где 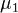 и
и 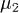 — химические потенциалы, а
— химические потенциалы, а 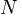 и
и 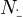 — числа частиц в первой и второй фазах соответственно.
— числа частиц в первой и второй фазах соответственно.
При этом сумма 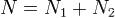 (полное число частиц в системе) меняться не может, поэтому можно записать
(полное число частиц в системе) меняться не может, поэтому можно записать
|
. |
Предположим, что 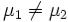 , для определенности,
, для определенности, 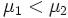 . Тогда, очевидно, минимум потенциала Гиббса достигается при
. Тогда, очевидно, минимум потенциала Гиббса достигается при 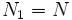 (все вещество перешло в первую фазу).
(все вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
 .
.
Уравнение Клапейрона — Клаузиуса
Основная статья: Уравнение Клапейрона — Клаузиуса
Из условия равновесия фаз можно получить зависимость давления в равновесной системе от температуры. Если говорить о равновесии жидкость — пар, то под давлением понимают давление насыщенных паров, а зависимость 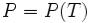 называется кривой испарения.
называется кривой испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:
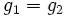 ,
,
где 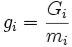 ,
, 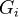 — потенциал Гиббса i-й фазы,
— потенциал Гиббса i-й фазы, 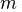 — её масса. Отсюда:
— её масса. Отсюда:
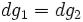 ,
,
азначит,
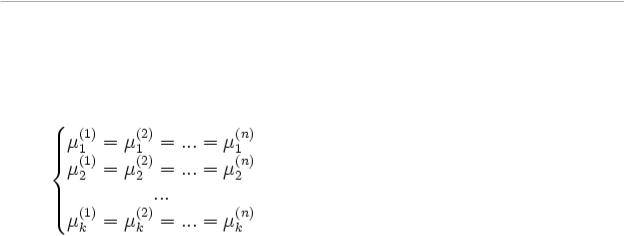
vk.com/club152685050 | vk.com/id446425943
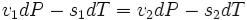 ,
,
где 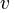 и
и  — удельные объем и энтропия фаз. Отсюда следует, что
— удельные объем и энтропия фаз. Отсюда следует, что
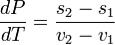 ,
,
и окончательно
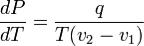 ,
,
где 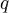 — удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
— удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
Правило фаз Гиббса
Рассмотрим теперь систему, вообще говоря, химически неоднородную (состоящую из нескольких веществ). Пусть 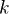 — число компонентов (веществ) в системе, а
— число компонентов (веществ) в системе, а 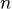 — число фаз. Условие равновесия фаз для такой системы можно записать в виде системы из
— число фаз. Условие равновесия фаз для такой системы можно записать в виде системы из 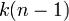 уравнений:
уравнений:
Здесь 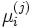 — химический потенциал для i-го компонента в j-й фазе. Он однозначно определяется давлением, температурой и концентрацией каждого компонента в фазе. Концентрации компонетнов не независимы (их сумма равна 1). Поэтому рассматриваемая система уравнений содержит
— химический потенциал для i-го компонента в j-й фазе. Он однозначно определяется давлением, температурой и концентрацией каждого компонента в фазе. Концентрации компонетнов не независимы (их сумма равна 1). Поэтому рассматриваемая система уравнений содержит  неизвестных (
неизвестных (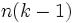 — концентрации компонентов в фазах, плюс температура и давление).
— концентрации компонентов в фазах, плюс температура и давление).
Система разрешима, вообще говоря, если число уравнений не превышает числа неизвестных (система, не удовлетворяющая этому условию, также может быть разрешима, однако это исключительный случай, с которым в физике можно не считаться). Поэтому
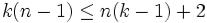 ,
,
отсюда
