
Лекция 2
.pdf
vk.com/club152685050 | vk.com/id446425943
Электродные
потенциалы

vk.com/club152685050 | vk.com/id446425943
УМК «ХИМИЯ»
Тема лекции: Электродные
потенциалы
Лектор – Иванов М.Г.

vk.com/club152685050 | vk.com/id446425943Цель лекции:
изложение основных понятий электродных потенциалов на границе металлраствор электролита в рамках современной химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе современных представлений о строении атомов и химической связи, возможность протекания ОВ реакций в расплавах и растворах электролитов.

vk.com/club152685050 | vk.com/id446425943
СОДЕРЖАНИЕ
Основные понятия Носители заряда
Связь электродного потенциала и энергии Гиббса Водородный электрод Уравнение Нернста
Потенциалы газовых электродов Диаграммы Латимера Диаграммы Пурбе Гальванический элемент
Элемент Даниэля Гальванический элемент с инертными электродами
Литература

vk.com/club152685050 | vk.com/id446425943 |
|
Основные понятия |
содержание |
|
По типу носителей заряда проводники электрического тока делят на две группы: в проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов).
Электродом называется проводник первого рода, контактирующий с проводником второго рода:

vk.com/club152685050 | vk.com/id446425943 |
|
Основные понятия |
содержание |
|
При погружении металла M в раствор, содержащий одноименные ионы Mn+ устанавливается динамическое равновесие между катионами Мn+, находящимися в растворе, и атомами М на поверхности электрода:
Me – ne + mH O |
[Me(H O) |
]n+ |
2 |
2 m |
|
|
|
|
Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно.

vk.com/club152685050 | vk.com/id446425943 |
|
Основные понятия |
содержание |
|
Электродный потенциал служит мерой изменения свободной энергии Гиббса ( G) в системе и указывает на направление окислительновосстановительного процесса:
Gо = – ЕоnF
G <0, когда E > 0 Самопроизвольный процесс
Gо = – RT•lnK |
|
O |
|
RT |
|
|
|
|
|
|
|
E |
|
nF ln K |
|||
|
|
||||

vk.com/club152685050 | vk.com/id446425943 |
|
Основные понятия |
содержание |
|
За величину электродного потенциала данного электрода в водородной шкале принимают ЭДС гальванического элемента:
Me/[Me(H2O)m]n+ (H2, H2SO4)/Pt
Стандартные значения потенциалов электродов (E0), при условиях: температура 298,15 К, давление газа (для газовых электродов) 1,013•105 Па,
концентрация потенциалопределяющих ионов - 1 моль/л.

vk.com/club152685050 | vk.com/id446425943 |
|
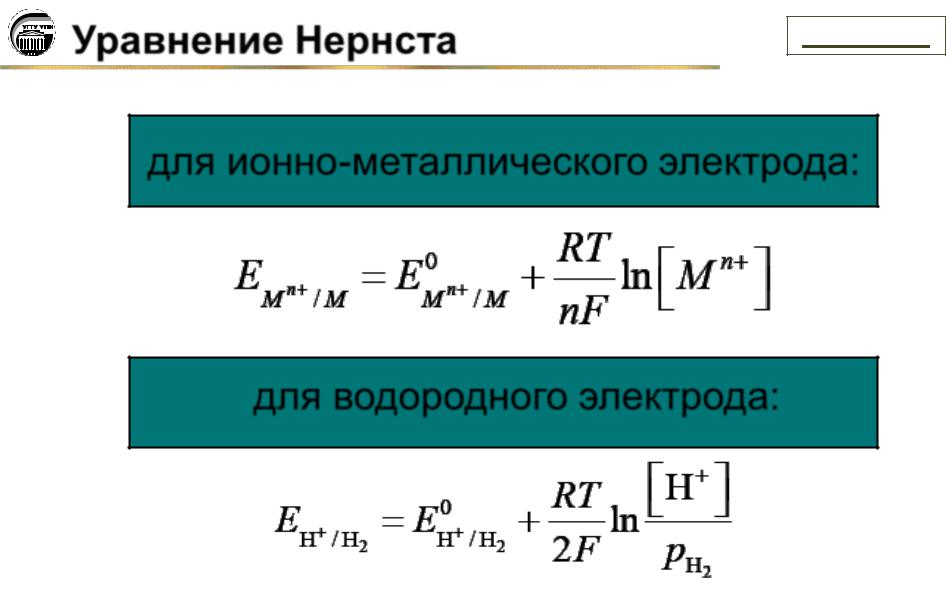
Уравнение Нернста |
содержание |
|
R F
T n
=8,314 Дж/(моль К) – универсальная газовая постоянная;
=96500 Кл/моль - постоянная Фарадея (заряд одного моля электронов);
–абсолютная температура, К;
–число электронов;
символы в квадратных скобках означает молярную концентрацию вещества.
vk.com/club152685050 | vk.com/id446425943 |
|
Уравнение Нернста |
содержание |
|
для ионно-металлического электрода:
для водородного электрода:
