
Лекция 2
.pdf
vk.com/club152685050 | vk.com/id446425943 |
|
Уравнение Нернста |
содержание |
|
При температуре 298,15 К уравнение Нернста для, полуреакции
MnO4 + 8H+ + 5e = Mn2+ + 4H2O
примет вид
E |
|
/Mn |
2 |
|
MnO |
|
|
|
4 |
|
|
=
Eo |
|
|
2 + |
0,059 lg |
[MnO4 ][H+]8 |
MnO4 |
/Mn |
|
5 |
[Mn2+] |
|

vk.com/club152685050 | vk.com/id446425943 |
|
Уравнение Нернста |
содержание |
|
Для реакций
2H |
|
2e H |
|
||
|
|
2 |
O2 + 4e + 4H+ = 2H2O;
E |
|
|
|
|
|
E |
o |
|
|
0,059pH |
||
2H |
|
/H |
|
|
2H |
|
/H |
|||||
|
2 |
|
|
|
2 |
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
E |
0 |
|
|
|
|
|
1,23 0,059pH. |
|||||
O |
/2H |
2 |
O |
|||||||||
|
|
|
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
||
vk.com/club152685050 | vk.com/id446425943 |
|
Диаграммы Латимера |
содержание |
|
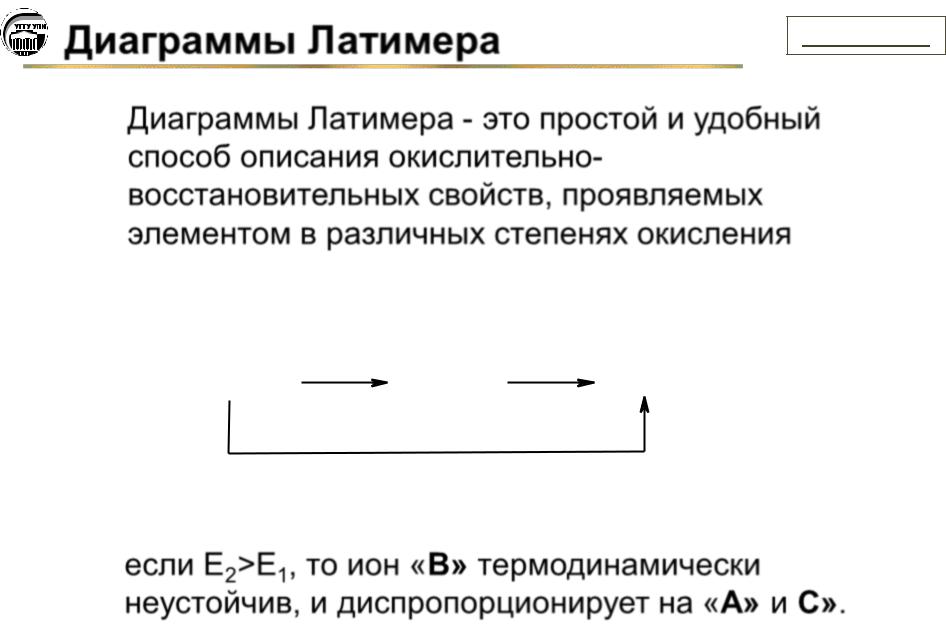
Диаграммы Латимера - это простой и удобный способ описания окислительновосстановительных свойств, проявляемых элементом в различных степенях окисления
E |
|
E |
1 |
|
2 |
A |
B |
C |
|
E |
|
|
3 |
|
если Е2>Е1, то ион «В» термодинамически неустойчив, и диспропорционирует на «А» и С».
vk.com/club152685050 | vk.com/id446425943 |
|
Диаграммы Латимера |
содержание |
|
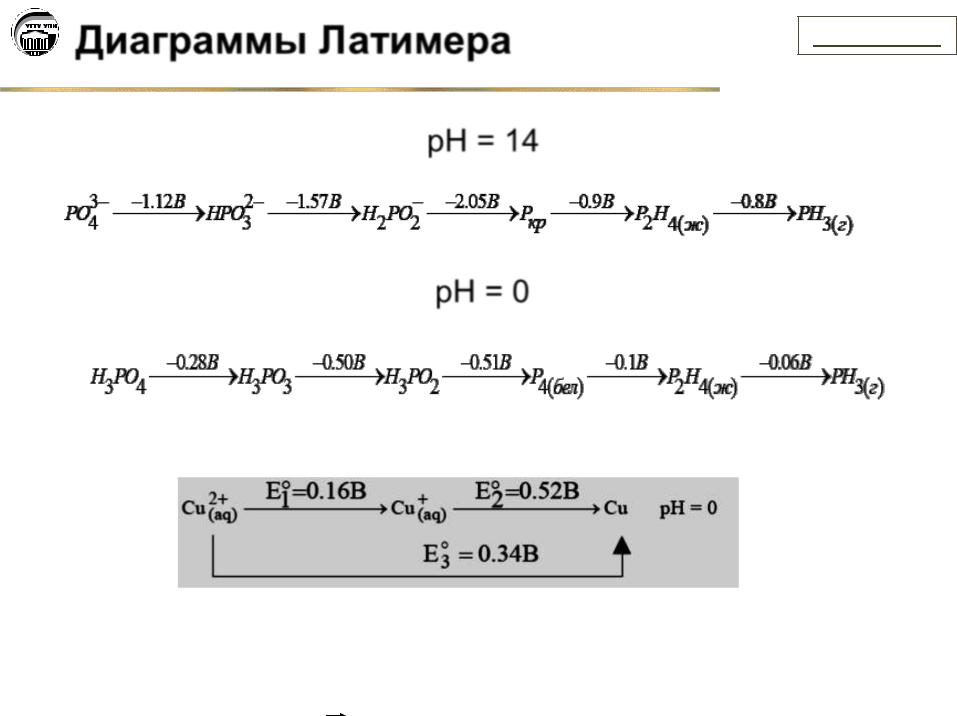
pH = 14
pH = 0
vk.com/club152685050 | vk.com/id446425943 |
|
Диаграммы Латимера |
содержание |
|
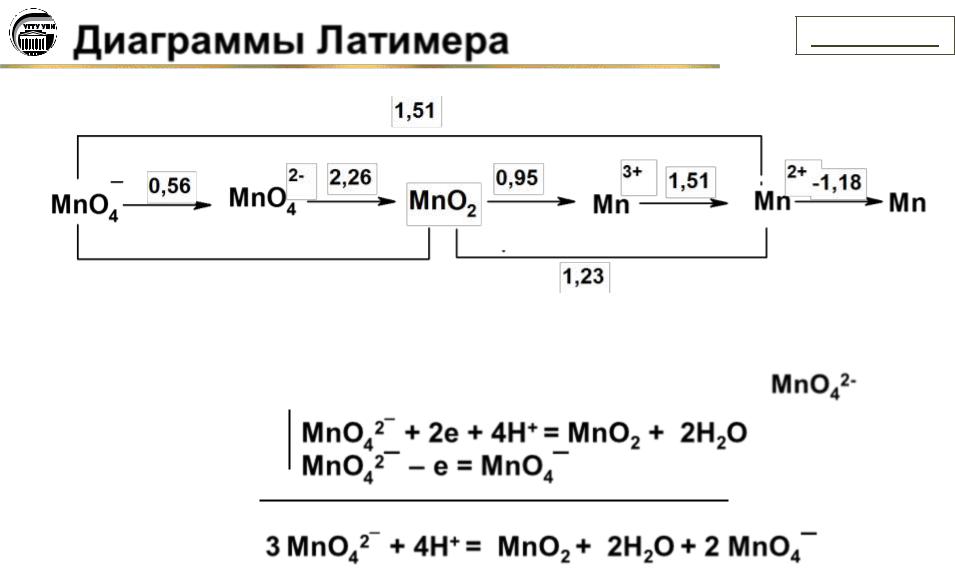
(при рН = 0)
неустойчивыми в кислой среде будут ионы MnO42- :
1MnO42¯ + 2e + 4H+ = MnO2 + 2H2O
2MnO42¯ – e = MnO4¯
3 MnO42¯ + 4H+ = MnO2 + 2H2O + 2 MnO4¯
∆Ео = ЕоОх - EоRed = 2,26 – 0,56 = 1,17B.
vk.com/club152685050 | vk.com/id446425943 |
|
Диаграммы Пурбе |
содержание |
|
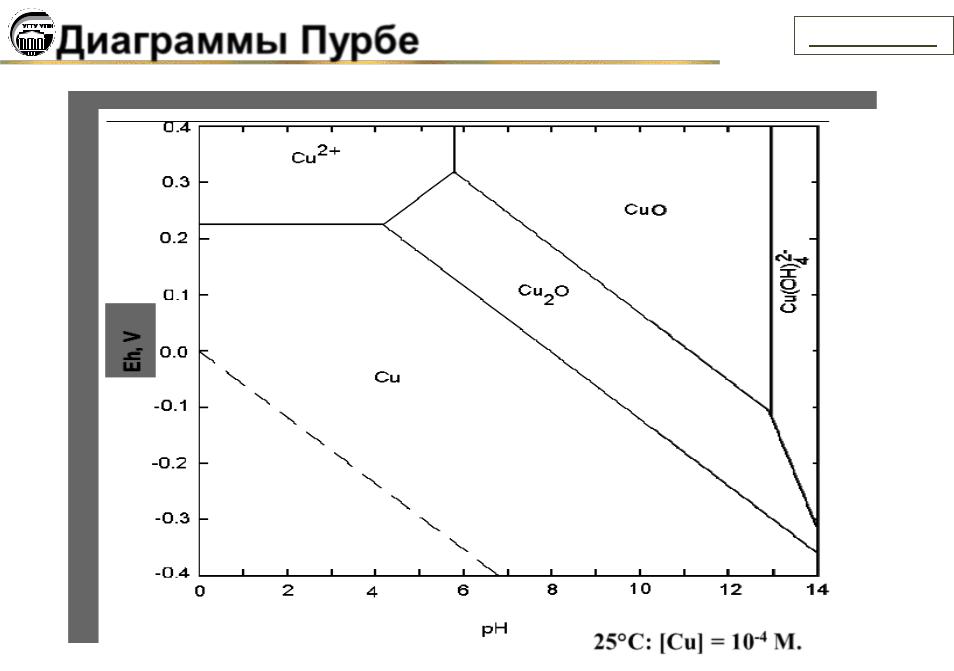
25°C: [Cu] = 10-4 M.
vk.com/club152685050 | vk.com/id446425943 |
|
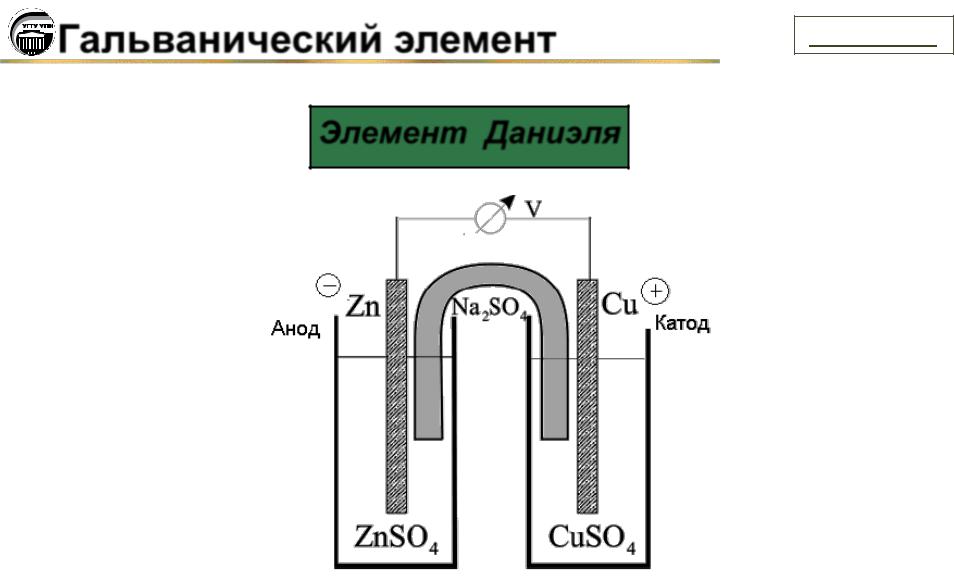
Гальванический элемент |
содержание |
|
Элемент Даниэля

vk.com/club152685050 | vk.com/id446425943 |
|
Гальванический элемент |
содержание |
|
Элемент Даниэля
Zn / ZnSO4 CuSO4 / Cu
Cu2+ + 2e = Cuo (катод, восстановление) Zno – 2e = Zn2+ (анод, окисление)
Zn0 + Сu2+ = Zn2+ + Cu0
ЭДС = ЕоОх - EоRed = 0,34 – (– 0,76) = 1,1B

vk.com/club152685050 | vk.com/id446425943 |
|
Гальванический элемент с |
содержание |
|
инертным электродом
Zn / ZnSO4 KMnO4, H2SO4, MnSO4, /С
2 |
MnO + 5e +8H+ = Mn2+ |
+ 4H O (катодный процесс ) |
|
4 |
2 |
5 |
Zno - 2e = Zn2+ |
(анодный процесс) |
2 MnO4 + 5Zn + 16H+ = 2Mn2+ + 5Zn2+ +8H2O
ЭДС = ЕоОх - EоRed = 1,51 – (– 0,76) = 2,27B

vk.com/club152685050 | vk.com/id446425943 |
содержание |
|
Выводы и заключения |
||
|
||
|
Электродные потенциалы является важнейшей является частью неорганической химии.
Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы.
