
Порядок выполнения лабораторной работы. Эксперимент. Математическая обработка результатов измерений
Включить установку, переведя зеленый тумблер на корпусе водородной лампы в положение «1». Дать прогреться водородной лампе в течении 3-5 минут.
Вращая ручку «винт 1» найти и просмотреть линии спектра водорода в видимой области, помещая глаз на расстоянии 5-10 см от окуляра зрительной трубы.
В предлагаемую таблицу 1 записать экспериментальные данные:
Таблица 1
№
|
Цвет линии
|
Длина волны ,нм |
Яркость линии |
|
|
||||
№ опыта |
|||||||||
1 |
2 |
3 |
4 |
5 |
|||||
1 |
Красный |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
2 |
Оранжевый |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
3 |
Желтый |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
4 |
Зеленый |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
5 |
Голубой |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
6 |
Синий |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
7 |
Фиолетовый |
|
|
|
|
|
Сильная |
|
|
|
|
|
|
|
|
|
Средняя |
|
|
|
|
|
|
|
|
|
Слабая |
|
|
Плавно вращая ручку "Винт 1" установить красную линию спектра в поле зрения окуляра. По шкале монохроматора определить длину волны данной линии. По зрительному ощущению определить цвет и яркость линий (сильная, средняя, слабая).
Повторить п. 4.4. для каждой видимой линии спектра.
Повторить п.п. 4.4. – 4.5. от трех до пяти раз по заданию преподавателя. Заполнить в таблице 1 столбцы 2, 3 или 2, 3, 4, 5.
Построить на миллиметровой бумаге спектр излучения водородной лампы – зависимость интенсивности излучения от длины волны. По оси X отложить длины волн, по оси Y – интенсивность полученных линий в относительных единицах (4см соответствует сильной , 2см – средней и 1см – слабой яркости).
Сравнивая полученные экспериментальные значения для всех наблюдаемых линий с табличными значениями длин волн спектра атомарного водорода, указать, какие из наблюдаемых линий относятся к атомарному, а какие к молекулярному водороду.
Вычислить постоянную Ридберга R, используя сериальную закономерность (1).
Для нахождения численных значений R необходимо заполнить таблицу 2:
Таблица 2
-
№
линии
Цвет
линии
Длина
волны
m
m2-n2
m2n2
R

1
3
2
4
3
5
4
6
По данным таблицы 2, используя метод Корнфельда, вычислить среднее значение R и абсолютную погрешность R:
 ;
;

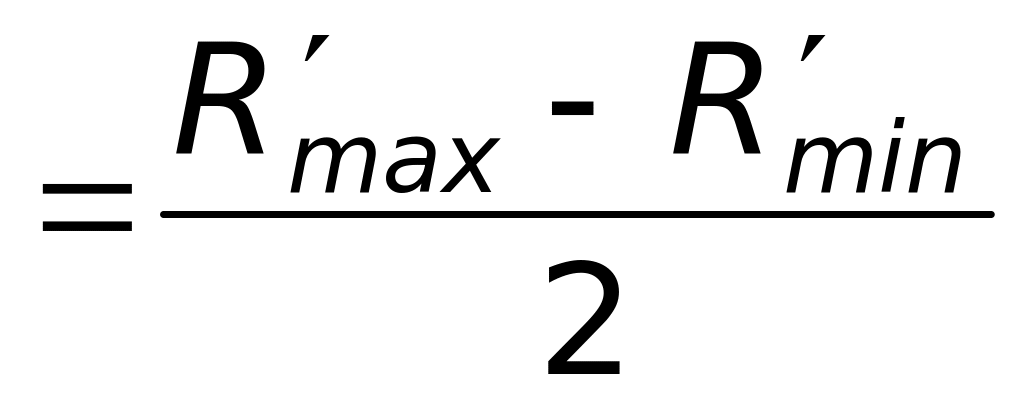 .
.Окончательный результат записать в виде: R = R R¢.
Вычислить теоретическое значение постоянной Ридберга
 ,
,
где h = 6,6310-34 Джс – постоянная Планка,
с = 3108м/с - скорость света,
me = 9,110-31кг - масса электрона,
e = 1,6 10-19Кл – заряд электрона,
0 = 8,8210-12 – электрическая постоянная.
4.13 Сравнить экспериментальное значение постоянной Ридберга R с теоретическим.
4.14. Вычислить длины волн, частоты и энергии квантов электромагнитного излучения первых трех перехода в сериях Лаймана и Пашена по экспериментальному значению постоянной Ридберга и заполнить таблицу 3 и таблицу 4:
Таблица 3
№ линии |
Серия Лаймана, n = 1 |
|||||
m |
, м |
, с-1 |
Е = h |
|||
Дж |
эВ |
|||||
1
2
3
|
|
|
|
|
|
|
Таблица 4
№ линии |
Серия Пашена, n = 3 |
|||||
m |
, м |
, с-1 |
Е = h |
|||
Дж |
эВ |
|||||
1
2
3
|
|
|
|
|
|
|
4.15. Определить при каких значениях т величины , и Е принимают максимальные и минимальные значения и вычислить значения этих величин.
max =
min =
max =
min =
Е max =
Е min =
4.16.
Вычислить
радиусы первых шести возможных орбит
электрона в атоме водорода Бора по
формуле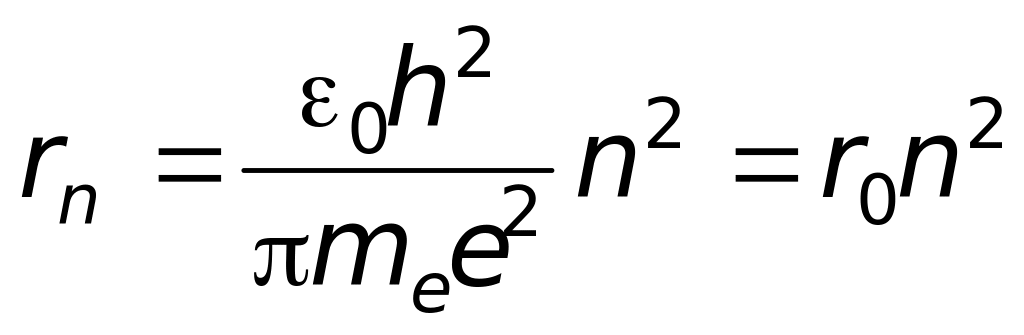 ,
,
где
 –
Боровский радиус. Боровским радиусом
называется наименьший радиус орбиты
электрона в атоме водорода.
–
Боровский радиус. Боровским радиусом
называется наименьший радиус орбиты
электрона в атоме водорода.
4.17. Схематически изобразить на миллиметровой бумаге круговые стационарные орбиты в модели атома водорода Резерфорда -Бора. Указать возможные переходы электрона, соответствующие излучению атома водорода в сериях Лаймана, Бальмера и Пашена (серию Бальмера изобразить цветными карандашами).
Сделать выводы по пунктам цели лабораторной работы (1.1 - 1.4), указывая, совпали или не совпали экспериментальные результаты в пределах абсолютной погрешности с табличными.
